研究開始時申請の流れ
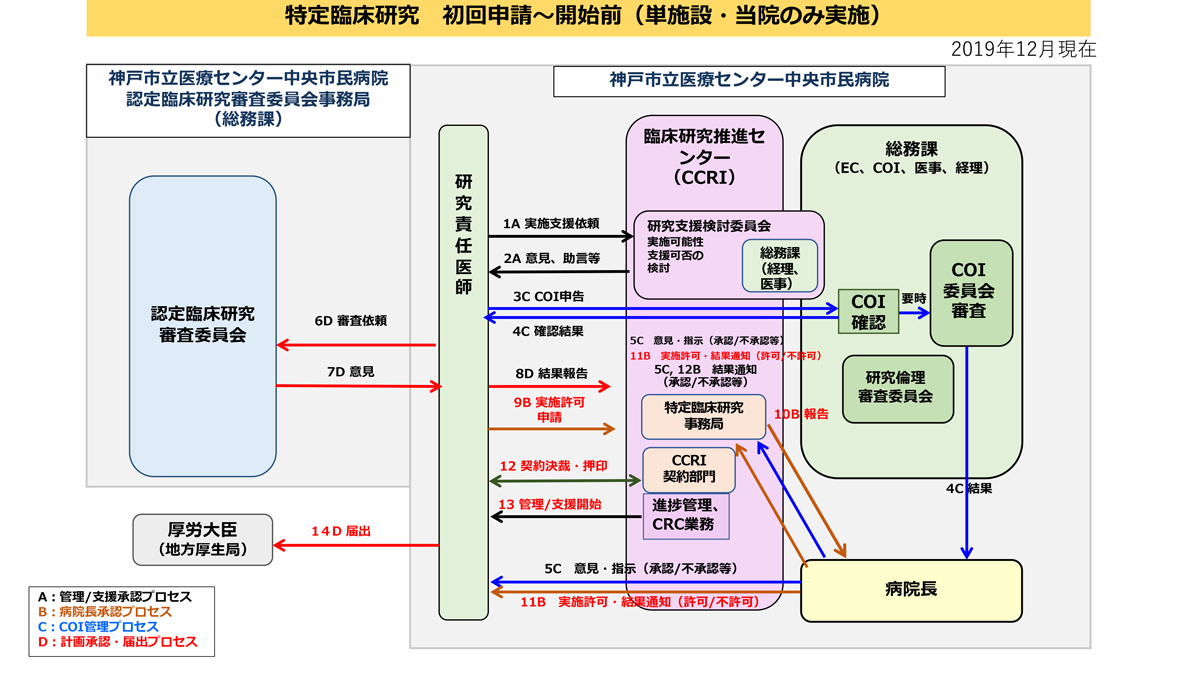
単施設・当院のみ実施
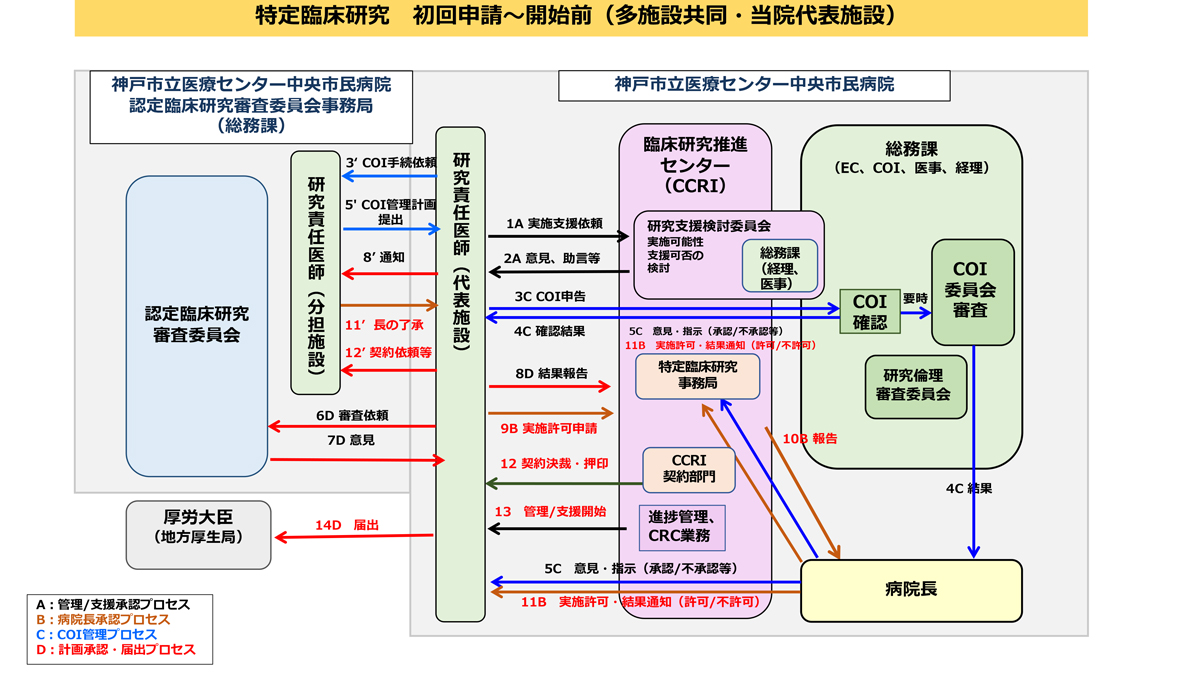
多施設共同・当院代表施設
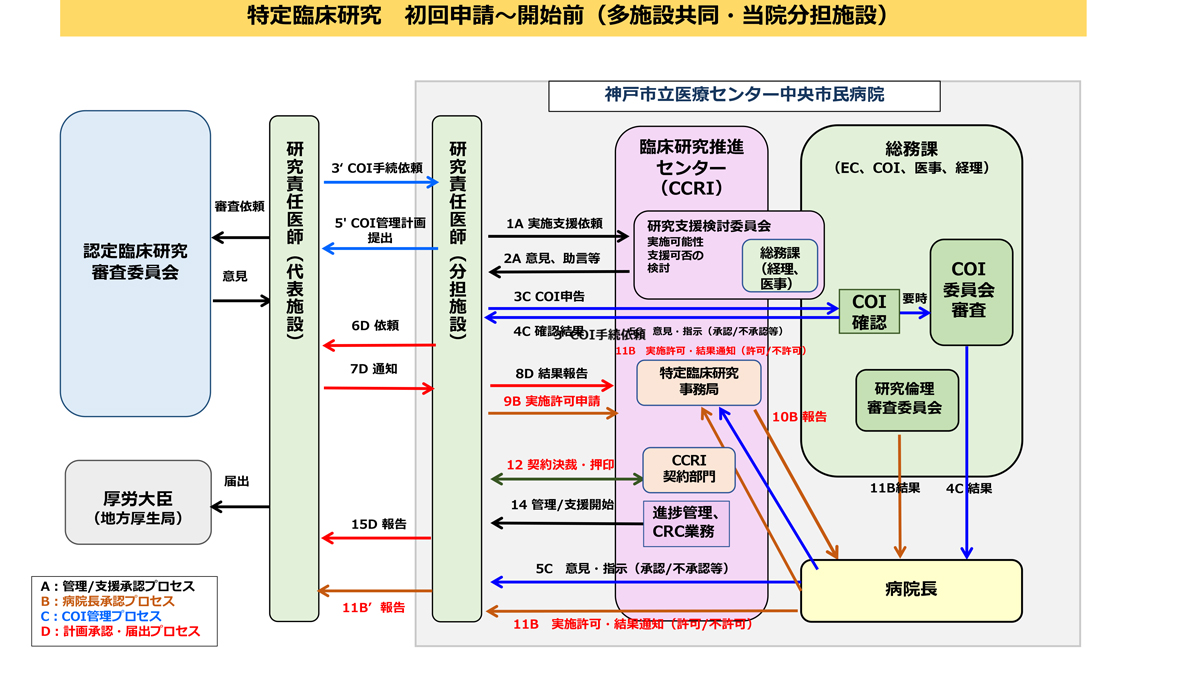
多施設共同・当院分担施設
新規申請
多施設共同・当院分担施設
特定臨床研究事務局への連絡
代表施設から研究参加の打診がありましたら、当院の特定臨床研究事務局へご一報ください。ご相談の上特定臨床研究の実施が決定しましたら、特定臨床研究等実施許可申請書をご提出いただきます。
特定臨床研究等実施許可申請書利益相反管理委員会への申告
代表施設からの求めに応じ、当院の利益相反管理委員会へ申告が必要です。申告手順については必ず特定臨床研究事務局にお問合せください。
代表施設による認定臨床研究審査委員会(以下CRB)への申請と承認後
- 代表施設がCRBにて承認を得られた後に、施設管理者の実施許可書が必要です。
- 実施許可書を入手されたのち、実施許可書の写しを代表施設へご提出ください。代表施設より一括で、jRCT(臨床研究実施計画・研究概要公開システム)への公表手続きがとられます。
- 必要に応じて当院と代表施設等による契約を締結してください。
「単施設・当院のみ実施」「多施設共同・当院代表施設」
特定臨床研究の実施をご検討されている段階で、まずは特定臨床研究事務局までご相談ください。特定の区分の判断が難しい場合や、研究実施の予算確保が困難な場合でも、お気軽にご相談ください。特定臨床研究の実施が決定しましたら、特定臨床研究等実施許可申請書をご提出いただきます。
特定臨床研究等実施許可申請書認定臨床研究審査委員会(以下CRB)への申請
研究の実施が決定しましたら、CRBへ申請し研究実施について承認を得る必要があります。申請に必要な書類は、特定臨床研究事務局からご説明いたしますが、CRB事務局ホームページを参考にしてください。
※当院が設置しているCRBではなく、他院のCRBでの申請をご希望される場合は、当該CRBへのご連絡が必要となります。
CRB事務局ホームページはこちら代表施設によるCRBへの申請と承認後
CRBの承認が得られたら、地方厚生局に届出し、jRCT(臨床研究実施計画・研究概要公開システム)への公表手続きをおこなってください。特定臨床研究事務局が手続きについて支援いたします。
特定臨床研究開始~終了
jRCTに「募集中」と公表されていることが確認できてから、研究が実施可能となります。
jRCTのWebサイトはこちら適切な同意取得について
特定臨床研究への参加においては、研究対象者への説明と文書による同意を取得することが大原則となります。CRBにて承認された説明文書・同意書を「電子カルテ_WEBMINK_医療情報部_C.依頼書_文書_登録・更新・削除 依頼書」を作成の上、医療情報部に電子カルテへ文書登録依頼を行ってください。(電子カルテ登録前に特定臨床研究事務局までご連絡ください)また、不備がないよう以下の資料を参考に適切に同意取得を行ってください。
| 資料名 | 参考資料 |
|---|---|
| 当院における同意書の使用方法 | |
| 本人からの同意書記載に関する注意点 | |
| 代諾者による同意書記載に関する注意点 |
※研究対象者が未成年の場合、インフォームド・アセントが必要になります。該当資料は掲載しておりませんが、研究開始前に特定臨床研究事務局と同意取得についてよくご相談ください。
実施中の各種報告書の提出について
研究実施中は随時各種報告書の提出が必要となります。当院が主任研究施設の場合と、分担施設の場合で必要な手続きが異なり煩雑なため、随時特定臨床研究事務局にご相談ください。
※分担施設の場合、主任研究施設との連絡には特定臨床研究事務局をccに入れておいていただくことをおすすめします。
臨床研究法で推奨されている書式(統一書式)変更申請
新規申請時に提出した書類に変更が生じた場合は、変更申請書および変更点一覧の提出が必要になります。
進捗状況の報告
実施状況について、1年に1回以上の頻度で報告を行う必要があります。
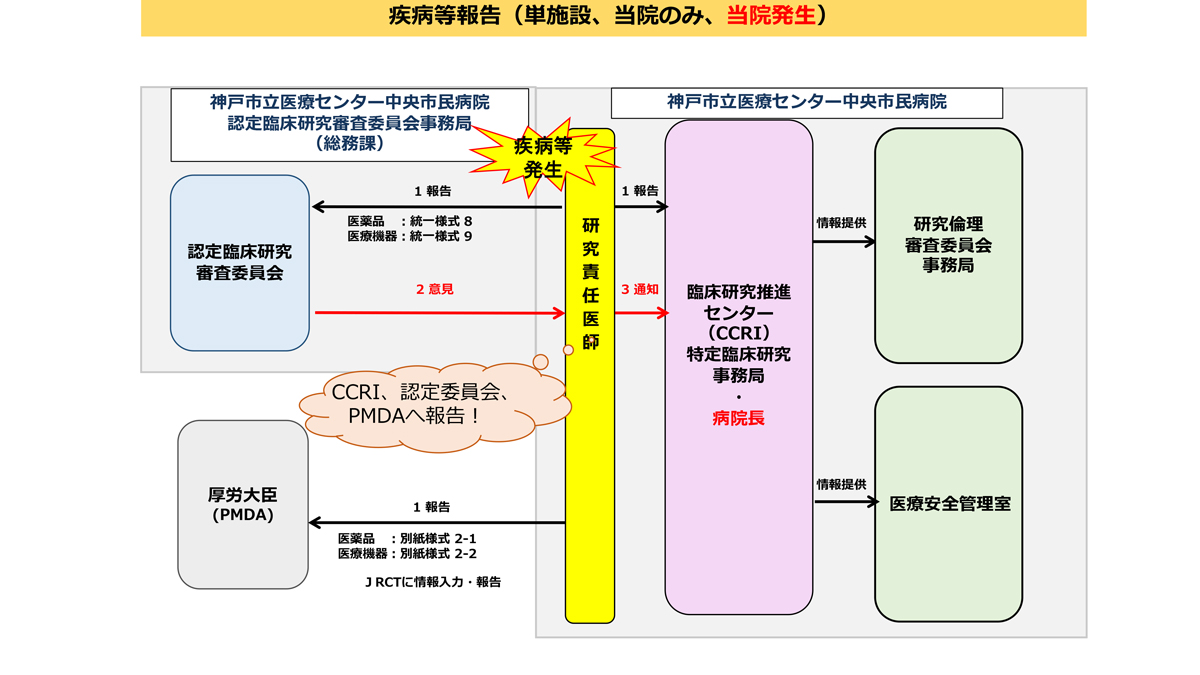
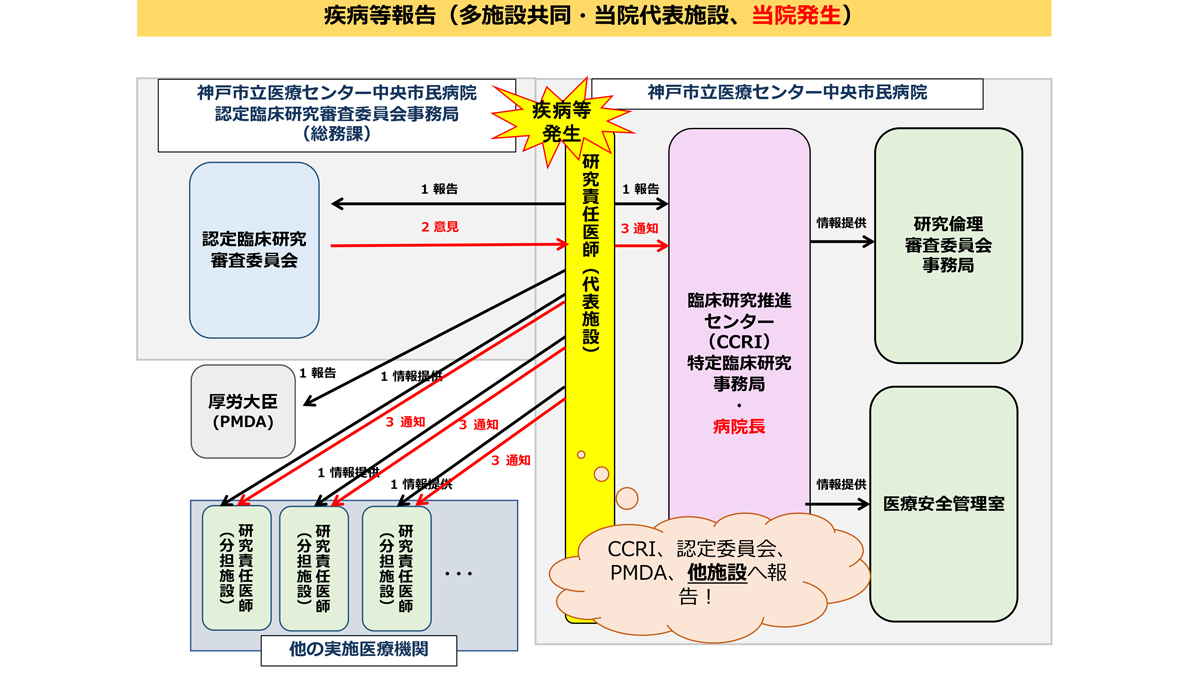
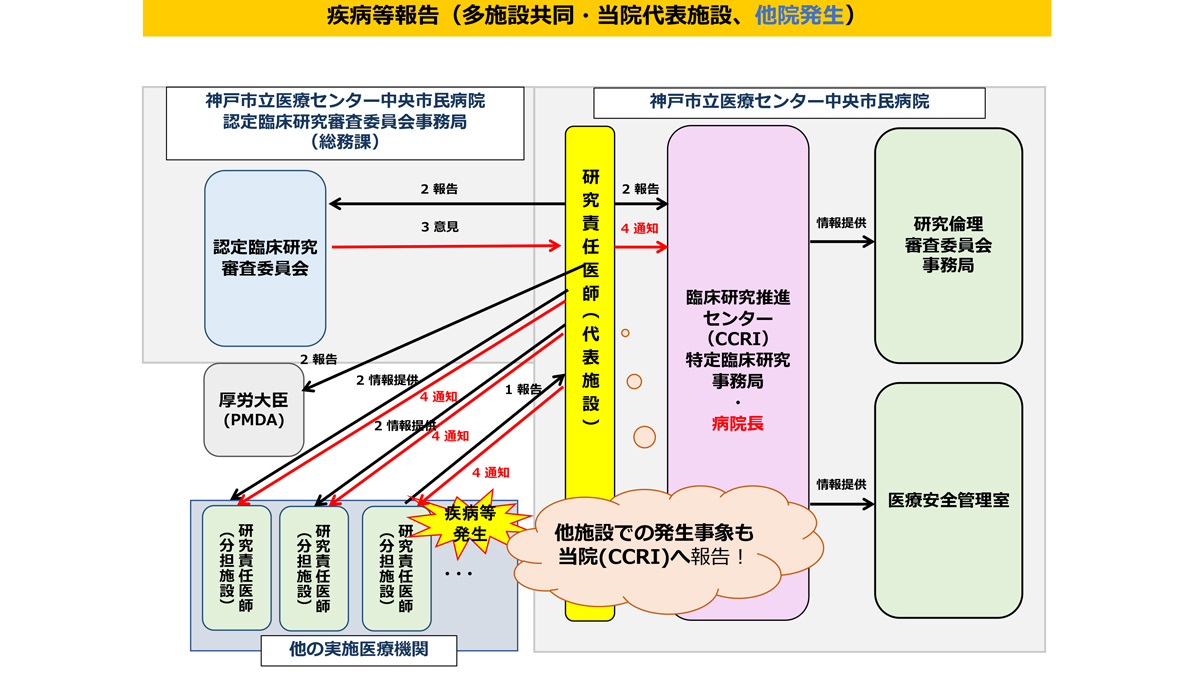
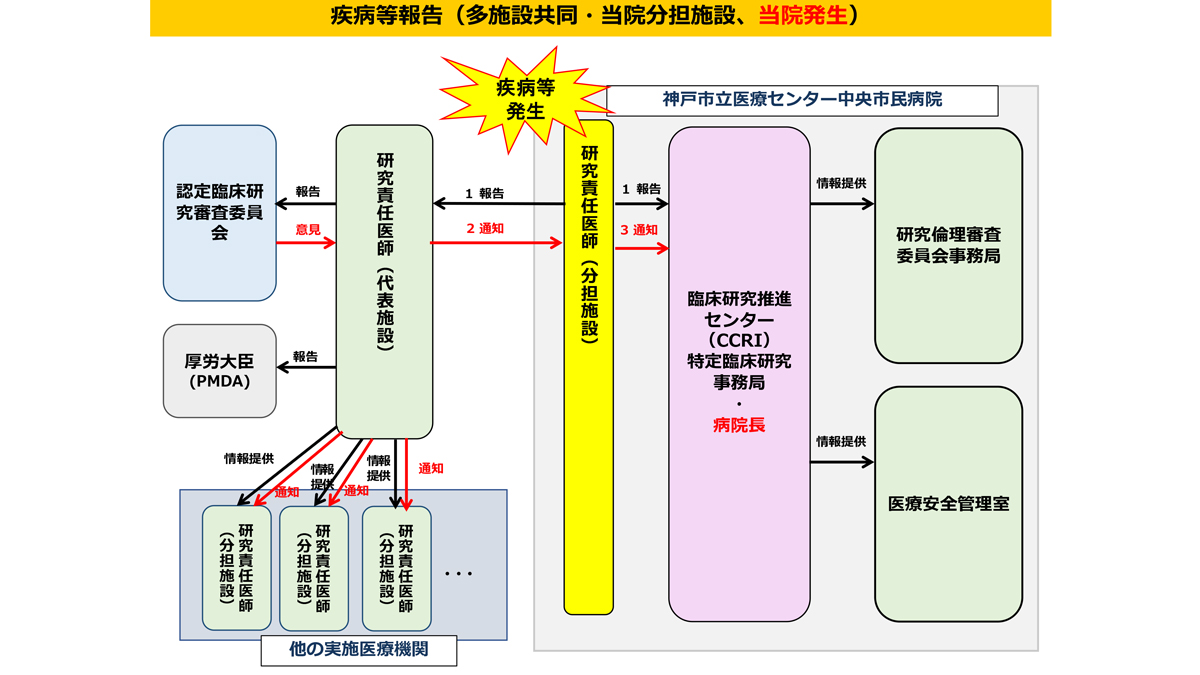
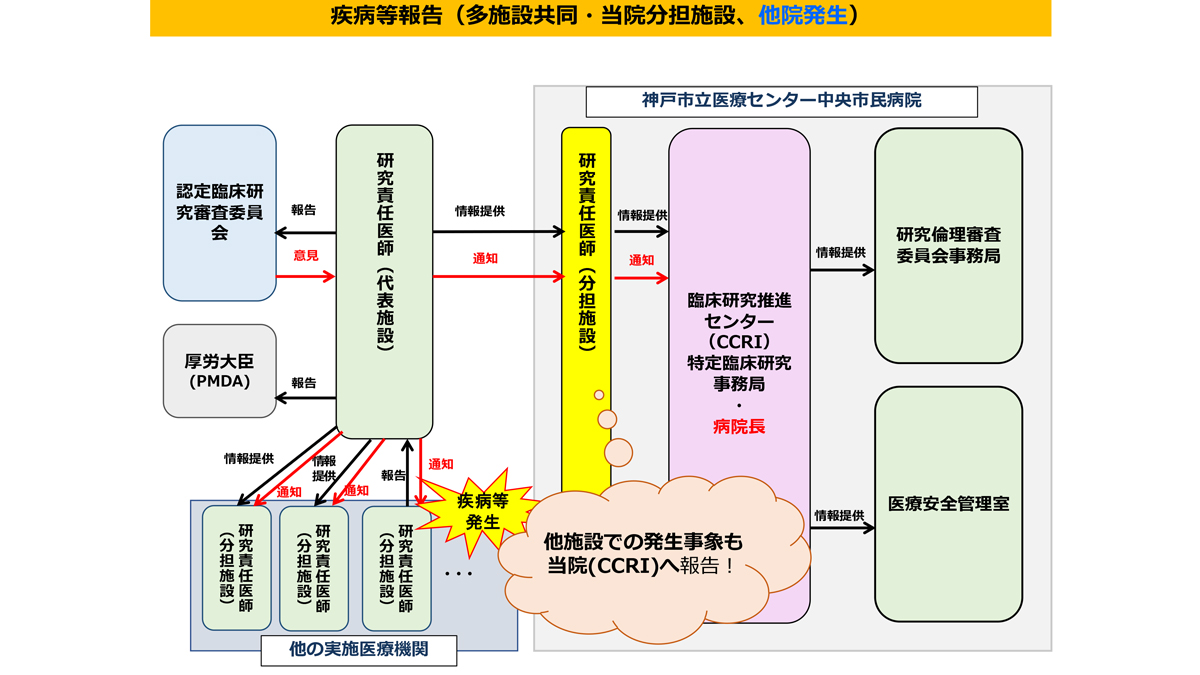
疾病等・不具合・不適合などの報告
研究期間中は、臨床研究法・研究実施計画書等に規定されている期限・手順を遵守し適切に報告書を提出してください。
モニタリングの実施と報告
研究実施計画書や手順書にのっとり、適切に実施と報告を行ってください。
※モニタリング担当者が当院に所属しない方の場合、当院の手続きについては「直接閲覧の手続き」をご参照下さい。
監査の実施と報告
実施の有無は研究毎に規定されています。監査を実施することが規定されている場合、研究実施計画書や手順書にのっとり、適切に実施と報告を行ってください。
※監査者が当院に所属しない方の場合、当院の手続きについては「直接閲覧の手続き」をご参照下さい。
終了・中止報告
臨床研究が終了・中止した際には「中止通知書」「終了通知書」の提出が必要となります。
直接閲覧の手続き
モニタリング・監査を目的として、当院に所属しない方が診療録を直接閲覧する際は、事前に以下の手続きを行ってください。
実施場所および日程の調整
研究責任者は、実施場所および日程について調整してください。
※臨床研究推進センターでの、当日対応(案内、付添等)はいたしかねます。必要な場合は実施診療科にてご対応ください(CRC対応案件を除く)。
提出資料
研究責任者は、電子カルテ_WEBMINK_医療情報部_B.利用申請_様式4-11臨床研究者の資料を作成し、医療情報部に提出してください。ID・PW発行までに1週間程度かかりますので、早めの申請をお願いいたします。
モニターの認定取得
原則として、モニターの指名を受けるには教育履歴を証明できるものが必要となります。
◆モニタリングの教育を受けたことが確認できる証明書を研究責任医師に提出してください。
e-learningやモニタリング講演会(他院での受講でも可)でも問題ありません。
証明書の提出が難しい場合は、下記e-learningにて受講し証明書を発行することも可能です。
CROCO モニタリング講習※詳細は各研究毎に規定が異なりますので、研究実施計画書や当該研究のモニタリング手順書など該当する資料をご確認の上、研究責任医師とお打ち合わせください。
特定臨床研究に関する当院様式と参考資料
| 様式 | 申請資料 | ダウンロード | 参考資料 |
|---|---|---|---|
| 様式1 | 疾病等(不具合)報告書 | ダウンロード | 「疾病等とは不具合とは」 「疾病等・不具合等報告期限」 |
| 様式2 | 不適合に関する報告書 | ダウンロード | 「不適合とは」 |
| ー | 特定臨床研究等実施許可申請書 | ダウンロード | |
| ー | 研究実施計画書 雛型 | ダウンロード | |
| ー | 説明文書・同意書 雛型 | ダウンロード | |
| ー | 不適合の管理に関する業務手順 | ダウンロード | |
| ー | 疾病等報告に関する業務手順 | ダウンロード | |
| ー | モニタリングの実施に関する手順書(基本)雛型 | ダウンロード | |
| 様式M-1 | モニタリング担当者指名書 雛型 | ダウンロード | |
| ー | (各種資料対応)変更点一覧雛型 | ダウンロード |
窓口(申請・問い合わせ)
特定臨床研究事務局
c_tokutei@kcho.jp
担当:菊 内線1509