DDworks Trial Siteの利用について
当院では治験に関する統一書式等の治験関連文書を電磁的に取り扱うため、富士通のクラウドシステム「DDworks Trial Site」を導入することとなりました。
新規試験及び継続中の試験について、それぞれ2024年1月及び2月の治験審査委員会で審査対象となる資料より、治験関連文書の電磁的授受・保管を実施する予定です。
1. DDworks Trial Site 依頼者様向け説明資料
DDworks Trial Siteシステム概要 依頼者向け操作説明 依頼者向け申請マニュアル(2024年1月12日更新) 当院からのお願い ユーザーズガイド システム化業務フロー SDV・監査の際の操作手順 アカウント発行申請書 DDworks Trial Siteの利用に関するFAQ2.標準業務手順書
治験手続きの電磁化における標準業務手順書 治験関連文書を電磁的記録として扱う際に確認すべきチェックリスト 治験審査委員会における電磁的記録の活用に関する手順書新規治験申請の流れ
1.施設選定・事前確認
治験依頼を検討されている場合の手順
1)治験事務局までご連絡ください。治験責任医師との面談調整、施設選定調査の受付、IRB初回申請のご案内等の対応をいたします。
施設選定調査/申請手続き/面会調整に関するお問い合わせは下記担当者までご連絡ください。
※初回の合意までは事務局を通して責任医師候補へご連絡させていただきます。
当院の治験実施体制(施設選定)/申請手続き
担当:臨床研究推進センター
メール:c_ccri@kcho.jp
電話番号:078-302-4499
2.事務局ヒアリング
| 開催日程 | 原則、IRB開催月の前月中旬頃にヒアリングを実施します。担当者と実施日時を調整してください。(初回合意は事務局ヒアリングまでにお済ませください。) |
|---|---|
| 所要時間 | 1時間程度です。 開発の経緯、治験薬の概要[作用機序、前相までの治験成績(有効性・安全性)等]、治験実施計画書の概要(試験デザイン、選択・除外基準、検査スケジュール等)について15分程度で説明してください。 |
| 出席者 | 治験事務局、IRB事務局、CRC、医事課、治験薬管理担当等が出席します。 |
| 準備資料 |
ヒアリング当日の資料として下記の資料を1週間前までにメールにて治験事務局宛てに送付してください。
|
3.申請(IRB開催月の1日締切)
IRBの申請方法はこちらをご参照ください。調整が必要な申請資料は以下のとおりです。
契約書および研究経費に係るポイント表、費用負担の資料
契約書、研究経費に係るポイント表及び費用負担に関する資料(※)
※新規申請のご案内時に雛形をお渡しいたします。
説明文書・同意書(ICF)の作成
遅くともIRB月の前々月の月末までに、依頼者様の雛形を担当CRCへご送付ください。担当CRCが院内の規定文言を含めて記載整備を行い、治験依頼者様と相談し、責任医師が最終確認する、という流れになります。
治験協力者の決定
治験協力者を決定してください(院内CRCまたはSMO選定)。
※院内CRCが支援できない場合は、当院規定を満たすSMOより選定していただきます。
4.治験審査委員会(IRB)(原則、毎月第4金曜開催)
当日は、治験責任医師が出席し、IRB委員に治験について説明します。
IRBの日程はこちらをご参照ください。IRB後、治験審査結果報告書、治験に関する指示・決定通知書を発行いたします。
5.契約締結
契約書 (押印済)を作成し、治験事務局にご提出ください。
6.臨床検査技術部、薬剤部の事前ミーティング
臨床検査技術部➡IRB翌月の第2火曜日
薬剤部➡薬剤部と依頼者様で日程調整
※治験事務局より検査部ミーティングの実施日時及び、薬剤部との日程調整依頼についてIRB前後に事務局よりお知らせいたします。
臨床検査技術部(約20分)
| 場所 | 本館3階 臨床検査技術部 |
|---|---|
| 出席者 | 臨床検査技術部(3名)、担当CRC、モニター、(中央測定機関担当者) |
| 必要資料(約8部) |
|
| その他 | CT、MRI、PET、病理、その他の打合せが必要な検査がある場合は、担当CRCと調整をお願いします |
薬剤部ミーティング(約40分)
| 場所 | 本館1階 薬剤部 |
|---|---|
| 出席者 | 治験薬管理担当者(2名)、担当CRC、治験事務局(適宜)、モニター |
| 必要資料(約5部) |
|
| その他 | 治験薬管理ファイル(※)をご持参ください(または事前に郵送)。 |
※:IRB後に治験薬管理ファイルの作成要領をお渡しします。
7.治験薬搬入
治験薬管理担当者と搬入日時および治験薬の受領者を調整してください。
連絡先
治験薬搬入場所:神戸市立医療センター中央市民病院 本館1階 薬剤部
搬入時間:9時~17時(土日祝日を除く)
8.スタートアップミーティング
治験責任(分担)医師、治験依頼者、担当CRC、その他治験協力者で、治験実施前の打ち合わせを行います。日程等の調整は担当CRCにご相談ください。
9.治験開始(継続審査、安全性報告、変更申請など)
治験実施計画書等の変更手続き、安全性報告、継続審査等に係るIRBの申請方法は、こちらをご参照ください。実施体制
臨床検査値一覧について
こちらのページから検査基準値一覧表をご確認ください臨床検査技術部の認証について
こちらのページから臨床検査技術部の認証をご確認ください治験薬保管庫の温度記録および温度計校正
| 機器 | 設定温度 | 温度計の機器名 | 測定頻度 | 校正期間 | 精度管理 | |
|---|---|---|---|---|---|---|
| 治験薬 保管庫 温度計 |
恒温槽 | 15-25℃ | 最高最低温度計 Traceable 冷蔵/冷凍庫用アラーム温度計 (サーモフィッシャーサイエンティフィックインコーポレイテッド) |
1日1回 (営業日のみ) |
2年 | 校正期間が過ぎるまでに買い替え |
| 冷蔵庫 | 2-8℃ | |||||
| 室温 | 1-30℃ | |||||
- 温度確認(温度逸脱の有無)は営業日のみ行う。確認者は確認時の温度、前回確認時からの最高・最低温度とイニシャルを温度確認記録用紙に記載する。確認記録用紙は薬剤部に保管している。
- 温度逸脱時は警報音が鳴る。警報音は設定温度内に回復するまで継続する。
- 治験薬保管庫(冷蔵庫・恒温槽)は非常用電源に接続されており、停電時には自家発電による電力供給に切り替わる。
※温度ロガーでの温度管理を希望される場合は、貸与をお願い致します。また、PCセキュリティーの都合上、温度記録の抽出は行っておりません。
逸脱時の対応
営業時間内の場合
治験薬管理補助薬剤師が速やかに状況を確認し対応する。
営業時間外の場合
当直薬剤師が速やかに状況を確認、治験薬管理補助薬剤師への連絡を行い、指示を仰ぐ。
直接閲覧について
利用登録について
治験契約締結後、直接閲覧時に必要となるID申請をしてください。以下の書類を作成の上、メールまたはDDTSにて治験事務局へご提出ください。
初回SDVの際に閲覧用IDをお渡ししますので、治験事務局までお立ち寄りください。
※当院での電子カルテへのアクセスは、参照権限にて直接閲覧を実施していただいております。
治験期間の延長により利用期間を延長される場合は見本をご参照の上、変更届を作成し事務局にご提出ください。
実施申込について
モニタリング及び監査については、事前に利用登録された専用IDのみで実施可能です。利用登録に2週間程度かかるため、早めに利用登録の申請をお願いします。
治験に係る文書又は記録の直接閲覧(必須文書閲覧)
治験事務局へ電子メールにより申し込みを行ってください。
(南館SDV室:紙原本)
- 紙原本の必須文書(事務局保管文書)閲覧は南館SDV室での実施となります。
電子メールにより事務局へ申請をしてください。 - 予約の受付は「議事録・SOP」「その他必須文書」のそれぞれ個別となりますが、
同時に予約することは可能です。 - 予約時には、閲覧対象となる期間(●年●月以降、等)を合せてお知らせください。
- 利用時間は、平日9時30分-17時といたします。
- SDV室利用前および利用後には、窓口(担当者)に必ずお声かけください。
- 同行者がある場合は、事前連絡の上、「必須文書閲覧のための誓約書」をPDFとし
てDDworks Trial Siteでご提出ください。 - 電子カルテの閲覧は可能です。
(DDworks Trial Site内保管文書)
- DDworks Trial Siteで保管している資料はリモートで閲覧が可能です。
- 閲覧についてはDDworks Trial SiteのQ&A機能から事務局へ申請してください。
- 利用時間は、平日9時30分-17時です。
- 関係者以外の方が閲覧できるような場所での閲覧はご遠慮ください。
- SDVが完了次第、Q&A機能から事務局へ連絡をしてください。
診療録および症例報告書の直接閲覧(症例SDV)
事前に担当CRCと日程調整を行った上で、実施日の10営業日前までに、担当CRCへ電子メールにより申し込みを行ってください。
- 必須文書閲覧を同時に実施する場合は、予約時にその旨を担当CRCにお伝えください。その際には、必須文書の閲覧対象となる期間(●年●月以降、等)を合せてお知らせください。
監査
事前に治験事務局と日程調整を行った上で、治験事務局へ電子メールにより申し込みを行ってください。実施当日のタイムスケジュールを別途ご提出ください。
実施当日について
ご来院の際に、下記の各実施場所の受付にお声掛けください。SDV室にご案内いたします。
| 実施場所 | 神戸市立医療センター中央市民病院 臨床研究推進センター <必須文書閲覧>南館4階SDV室 <症例SDV>本館3階SDV室 |
|---|---|
| 時間帯 | 9:30~17:00(月~金・祝日除く) |
※SDV室利用前および利用後には、窓口(担当者)に必ずお声かけください。
Q&A
新たに後任者のID申請手続きを行ってください。
IDが発行されましたら、前任者のID利用停止手続きを行いますので、事務局にてお手続きください。
最終の必須文書閲覧は、原則終了報告書提出前にしてください。
万一、終了報告書提出後に閲覧が必要な文書がある場合は治験事務局へご相談ください。
経費の取扱いについて
費用は原則、半期ごとに請求させていただきます。
※検査費等支給対象外費用のみ、毎月請求
臨床試験費用
契約書、研究経費に係るポイント表及び費用負担に関する資料(※)
※新規申請のご案内時に雛形をお渡しいたします。
院内CRC費用
院内CRCが支援する場合、CRC費用を算出し、提案させていただきます。
※臨床試験費用、院内CRC費用とも出来高払いです。
IRB審査手数料(本審査・迅速審査)
審査料は以下の通り発生します。
| 本審査 | 31,200円(税別)/1案件 |
| 迅速審査 | 31,200円(税別)/1案件 |
※書式 1、2、4、5、9、17~18は該当しません。
※書式 3、10、11、16→各1案件/月
※書式 12、14、19→第1報のみ/1案件
・治験責任/分担医師の変更等、当院実施体制変更に係る審査は審査料をいただきません。
・半期ごとに纏めてご請求させて頂きます。
検査費等支給対象外費用
医事課より請求書を送付いたします。請求書が届き次第、速やかにお支払いください。当院では、保険点数1点あたり保険診療分は10円、自由診療分は12円で算定いたします。
※当院では、原則として以下の取扱いとなります。
| 期間 | 同意日~治験薬投与開始前 | 治験薬投与期間 | 治験薬投与終了後~後観察終了 |
|---|---|---|---|
| 治験依頼者のご負担内容 | 治験に係る検査、画像診断費用の患者自己負担分 | 全ての検査・画像診断費用、治験薬の同種同効薬費用全額 | 治験に係る検査、画像診断費用の患者自己負担分 |
負担軽減費
7,000円/Visitが基本です。実績に応じて経営企画課よりご請求させていただきます。
システム利用料・文書保管費用
| 文書管理システム利用料 | 1契約につき10,000円(税別)/月 (IRB申請月から終了報告書IRB報告月まで) |
| 文書保管費用 | 電子での保管のみとなる場合には文書保管費用は発生いたしません。 |
紙媒体資料保管費用
保管スぺース等の事情により、治験終了後の治験に係る文書保管・管理費用をいただいております。以下の算出式に基づき算出した費用をご請求させていただきます。
保管ファイル冊数×(治験依頼者の求める治験終了後保管年数÷3)×10,000円(税別)
※1,000円未満の端数は切り上げとします。
病院管理費用
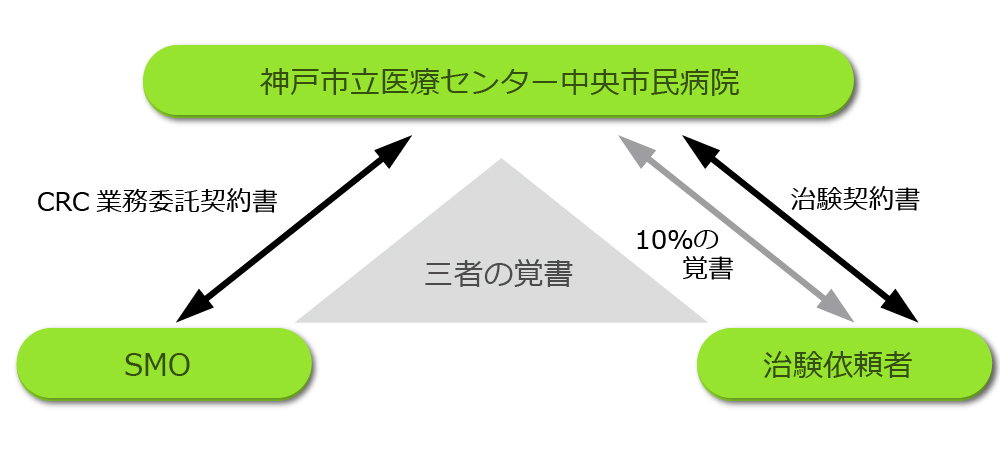
SMO委託時に発生する費用です。SMOから依頼者様に請求された治験コーディネータ経費の10%の金額を請求させていただきます。業務委託契約書と併せて覚書を締結させていただきます。(下図参照)
その他
提出用検体の作製が必要な場合は作製費用が別途発生します。詳細はご相談ください。
病院長の交代について(2020年4月1日付)
病院長の交代について(2020年4月1日付)過去の「病院長の交代について」お知らせ
| 2018年2月1日付 | 病院長の交代について |