神戸市民病院機構 臨床研究審査委員会
| 委員会の名称 |
神戸市民病院機構 臨床研究審査委員会 |
| Name of Certified Review Board |
Kobe city hospital organization certified review board |
| 認定番号 |
CRB5220001 |
| 委員会の所在地 |
兵庫県神戸市中央区港島南町2-1-1 |
| Adress |
2-1-1, Minatojima-minamimachi, Chuo-ku, Kobe-city, Hyogo, 650-0047, Japan |
| 電話番号 |
078-302-5176 |
| メールアドレス |
c_crb@kcho.jp |
臨床研究審査委員会とは
神戸市立医療センター中央市民病院臨床研究審査委員会は、臨床研究法に基づき、「特定臨床研究」等について、同法及び関係省令に基づく審査意見業務を行います。
地方独立行政法人神戸市民病院機構 臨床研究審査委員会設置規程
神戸市民病院機構臨床研究審査委員会標準業務手順書
臨床研究審査委員会 委員名簿
議事概要
臨床研究審査委員会の議事概要
審査受付等について
審査受付手順
審査申込前のチェックリスト
審査手数料
臨床研究法について(詳細・様式等)
厚労省 臨床研究法について(厚労省ページへリンク)
申請受付相談等窓口
神戸市立医療センター中央市民病院 臨床研究審査委員会事務局
TEL:078-302-5176
MAIL:c_crb@kcho.jp
(旧)厚生労働大臣認定 臨床研究審査委員会 ~令和5年2月28日
神戸市立医療センター中央市民病院臨床研究審査委員会は2023年2月末にて廃止になりました。
| 委員会の名称 |
神戸市立医療センター中央市民病院 臨床研究審査委員会 |
| Name of Certified Review Board |
Kobe city medical center general hospital certified review board |
| 認定番号 |
CRB5190001 |
| 委員会の所在地 |
兵庫県神戸市中央区港島南町2-1-1 |
| Adress |
2-1-1, Minatojima-minamimachi, Chuo-ku, Kobe-city, Hyogo, 650-0047, Japan |
| 電話番号 |
078-302-5176 |
| メールアドレス |
c_crb@kcho.jp |
臨床研究審査委員会とは
神戸市立医療センター中央市民病院臨床研究審査委員会は、臨床研究法に基づき、「特定臨床研究」等について、同法及び関係省令に基づく審査意見業務を行います。
委員会
公開情報
地方独立行政法人神戸市民病院機構 臨床研究審査委員会設置規程
神戸市立医療センター中央市民病院臨床研究審査委員会標準業務手順書
臨床研究審査委員会 委員名簿
議事概要
臨床研究審査委員会の議事概要
令和4年度
令和3年度
令和2年度
令和元(平成31)年度
審査受付等について
審査受付手順
審査申込前のチェックリスト
審査手数料
委員会開催予定等 2022年度
臨床研究法について(詳細・様式等)
厚労省 臨床研究法について(厚労省ページへリンク)
申請受付相談等窓口
神戸市立医療センター中央市民病院 臨床研究審査委員会事務局
TEL:078-302-5176
MAIL:c_crb@kcho.jp
治験審査委員会
治験審査委員会
| 名称 |
神戸市立医療センター中央市民病院 治験審査委員会 |
| 所属 |
地方独立行政法人神戸市民病院機構 神戸市立医療センター中央市民病院 |
| 所在地 |
神戸市中央区港島南町2丁目1番地1号 |
| 設置日 |
平成10年4月1日 |
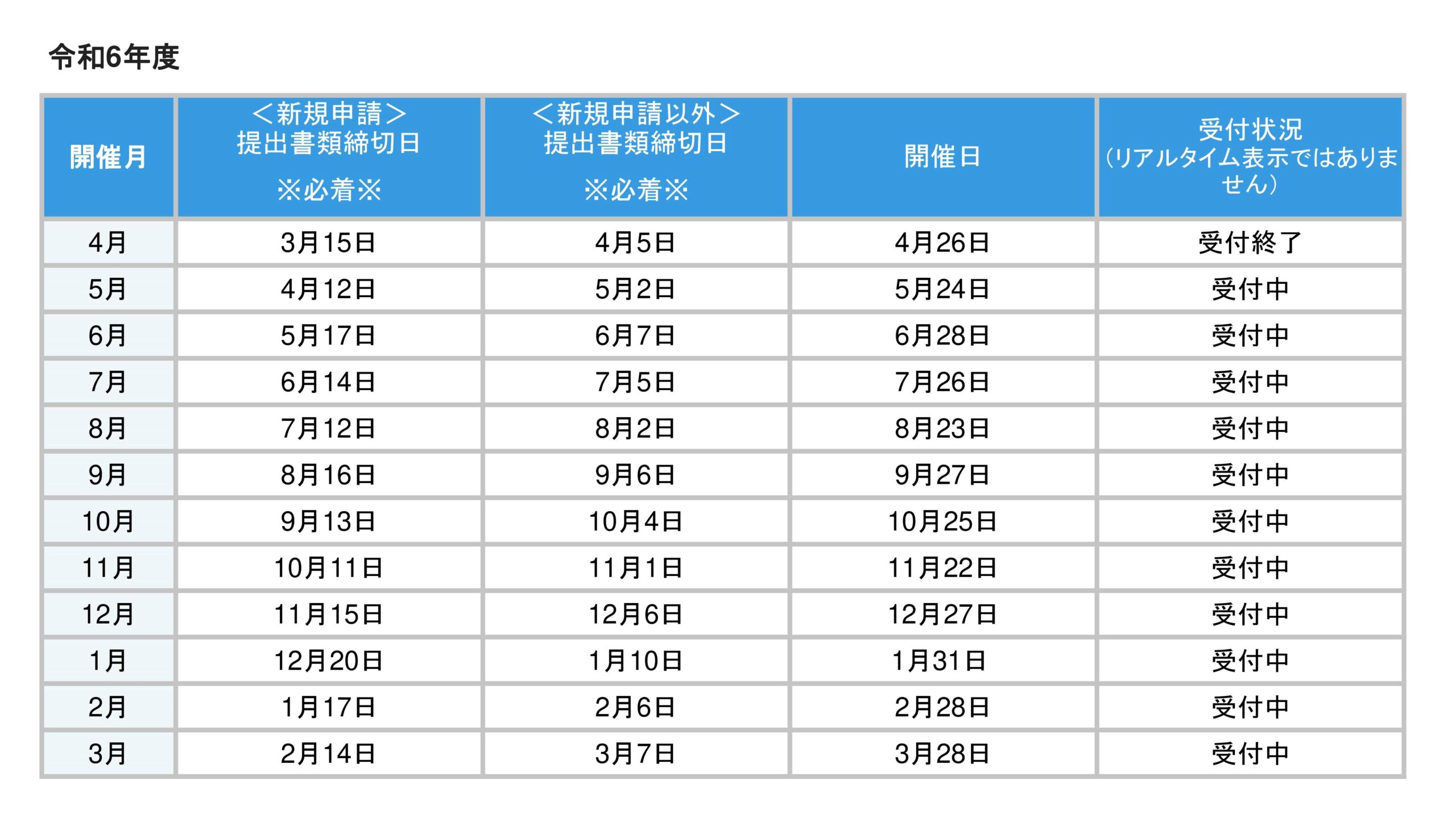
令和6年度
| 開催月 |
提出書類締切日
※必着※
|
開催日 |
| 4月 |
4月1日 |
4月26日 |
| 5月 |
5月1日 |
5月24日 |
| 6月 |
6月3日 |
6月28日 |
| 7月 |
7月1日 |
7月26日 |
| 8月 |
8月1日 |
8月23日 |
| 9月 |
9月2日 |
9月27日 |
| 10月 |
10月1日 |
10月25日 |
| 11月 |
11月1日 |
11月22日 |
| 12月 |
12月2日 |
12月27日 |
| 1月 |
12月27日 |
1月31日 |
| 2月 |
2月3日 |
2月28日 |
| 3月 |
3月3日 |
3月28日 |
※1月は第5週目開催となります。
委員名簿
| 氏名 |
資格 |
所属・職名 |
備考 |
| 古川 裕 |
医師 |
中央市民病院副院長 |
委員長 |
| 安田 義 |
医師 |
中央市民病院副院長 |
副委員長 |
| 今別府 敏雄 |
― |
元厚生労働省医薬食品局長 |
外部委員 |
| 内布 敦子 |
看護師 |
敦賀市立看護大学理事長・学長 |
外部委員・女性委員 |
| 大門 貴志 |
― |
兵庫医科大学医療統計学教授 |
外部委員 |
| 中嶋 展也 |
弁護士 |
中嶋徹法律事務所 |
非専門委員 |
| 菅澤 真央 |
― |
兵庫県立こども病院管理局長 |
非専門委員 |
| 人羅 亜矢子 |
― |
NPO法人KOBE子育てネット理事長 |
非専門委員・女性委員 |
| 藤原 のり子 |
看護師 |
中央市民病院看護部長 |
女性委員 |
| 松井 誠一郎 |
医師 |
神戸市医師会副会長 |
外部委員 |
| 丸山 英二 |
― |
神戸大学名誉教授 |
外部委員 |
| 室井 延之 |
薬剤師 |
中央市民病院薬剤部長 |
|
治験審査委員会委員名簿兼指名書(令和6年4月1日)
過去の委員名簿兼指名書
標準業務手順書
申請手順
依頼者向け申請マニュアルをご参照ください。
依頼者向け申請マニュアル
IRB開催月の締め切り日までに、申請書類をDDworks Trial Siteへ送付ください(厳守)。
標準業務手順書・各様式
統一書式一覧(企業主導治験、製造販売後臨床試験)
新統一書式(令和4年11月30日付け)で運用しております。
当院では安全性情報(書式16)のIRB審査において責任医師の見解が必要です。
責任医師見解は書式16備考欄にご記載頂くか必要に応じて参考書式9をご使用ください。
医師主導治験は厚生労働省のホームページに公開されている統一書式をご使用ください。
議事概要
議事概要の公開要綱
当院での議事概要公開範囲について(第5版)
治験審査委員会の議事概要
令和5年度
令和4年度
令和3年度
令和2年度
令和元(平成31)年度
平成30年度
平成29年度
平成28年度
平成27年度
平成26年度
平成25年度
平成24年度
平成23年度
平成22年度
平成21年度
研究倫理審査委員会
研究倫理審査委員会では、人を対象とする医学系研究に関する倫理指針、ヒトゲノム・遺伝子解析研究に関する倫理指針、および遺伝子治療等臨床研究に関する指針に準じて実施される臨床研究について、倫理的観点及び科学的観点から、当院、研究者等の利益相反に関する情報も含めて中立的かつ公正に審査を行います。
当院では、院外の研究機関からの申請も受け付けております。当委員会での審査を希望される方は、以下の臨床研究事務局まで直接お問い合わせください。
臨床研究事務局
TEL:078-302-5176
Mail:rinken@kcho.jp
開催日時
令和6年度
| 開催月 |
提出書類締切日
※必着※
|
開催日 |
| 4月 |
4月1日 |
4月26日 |
| 5月 |
5月1日 |
5月24日 |
| 6月 |
6月3日 |
6月28日 |
| 7月 |
7月1日 |
7月26日 |
| 8月 |
8月1日 |
8月23日 |
| 9月 |
9月2日 |
9月27日 |
| 10月 |
10月1日 |
10月25日 |
| 11月 |
11月1日 |
11月22日 |
| 12月 |
12月2日 |
12月27日 |
| 1月 |
12月27日 |
1月31日 |
| 2月 |
2月3日 |
2月28日 |
| 3月 |
3月3日 |
3月28日 |
※1月は第5週目開催となります。
委員一覧
| 氏名 |
資格 |
所属・職名 |
備考 |
| 古川 裕 |
医師 |
中央市民病院副院長 |
委員長 |
| 安田 義 |
医師 |
中央市民病院副院長 |
副委員長 |
| 今別府 敏雄 |
― |
元厚生労働省医薬食品局長 |
外部委員 |
| 内布 敦子 |
看護師 |
敦賀市立看護大学理事長・学長 |
外部委員・女性委員 |
| 大門 貴志 |
― |
兵庫医科大学医療統計学教授 |
外部委員 |
| 中嶋 展也 |
弁護士 |
中嶋徹法律事務所 |
非専門委員 |
| 菅澤 真央 |
― |
兵庫県立こども病院管理局長 |
非専門委員 |
| 人羅 亜矢子 |
― |
NPO法人KOBE子育てネット理事長 |
非専門委員・女性委員 |
| 藤原 のり子 |
看護師 |
中央市民病院看護部長 |
女性委員 |
| 松井 誠一郎 |
医師 |
神戸市医師会副会長 |
外部委員 |
| 丸山 英二 |
― |
神戸大学名誉教授 |
外部委員 |
| 室井 延之 |
薬剤師 |
中央市民病院薬剤部長 |
|
研究倫理審査委員会委員名簿兼指名書(令和6年4月1日付)
申請手順
新規申請
臨床研究の計画、実施体制等が固まったら、以下の申請資料を臨床研究事務局まで電子ファイルで提出してください。提出された申請資料は、臨床研究事務局で事前に確認されます。修正等の指摘があった場合は、適切に修正し、申請資料を再提出してください。確定された申請資料をもって、研究倫理審査委員会にて申請を正式に受け付けます。
委員会開催月の1日(1日が休日の場合は翌平日)までに確定された申請資料をご提出ください。
・研究実施許可申請書(兼 審査依頼書)
・研究者等リスト
・研究計画書
・同意説明文書・【院内限定】同意書※(文書同意の場合)
1枚パターン
2枚パターン
・情報公開文書
・添付文書(必要に応じて)
・症例報告書の見本(必要に応じて)
・加入保険見積書(必要に応じて)
・主幹施設の倫理委員会承認通知書(当院が共同研究施設の場合)
・その他(アンケート用紙など)
・【院内限定】※同意書および情報公開文書は下記の当院書式を用いて作成してください。
研究倫理審査委員会
介入を伴う研究の新規申請について
研究責任者は、研究倫理審査委員会で研究の概要を説明いただきます。研究倫理審査委員会より日時をご連絡しますので、お伝えした時間に所定の場所にお越しください。
変更申請
研究計画書、同意説明文書、実施体制(研究者の変更等)などに変更が生じた場合は、以下の申請資料を研究倫理審査委員会まで電子ファイルをご提出ください(委員会開催月の1日(1日が休日の場合は翌平日)〆)。
変更申請書
【院内限定】変更点一覧(任意)
進捗状況の報告
実施中の臨床研究の実施状況について、以下の様式を用いて、原則として1年に1回以上の頻度で報告してください。
実施状況報告書
重篤な有害事象報告
重篤な有害事象が発現した際には、以下の様式を用いて報告してください。
重篤な有害事象等報告書
または
監査結果の報告
監査者は、監査結果を病院長に報告する必要があります。作成した監査報告書をご提出ください。当院規定のフォーマットはありません。
終了・中止報告
臨床研究が終了または中止した際には、以下の様式を用いて報告してください。
終了(中止)報告書
窓口(申請・問い合わせ)
臨床研究事務局
rinken@kcho.jp
078-302-5176(PHS7736)
標準業務手順書・各様式
臨床研究法
詳細はこちら(厚労省ページへリンク)
倫理指針
人を対象とする生命科学・医学系研究に関する倫理指針(「統合指針」)(厚労省ページへリンク)
人を対象とする医学系研究に関する倫理指針(「医学系指針」)(厚労省ページへリンク)
ヒトゲノム・遺伝子解析研究に関する倫理指針(「ゲノム指針」)(厚労省ページへリンク)
遺伝子治療等臨床研究に関する指針
標準業務手順書
研究倫理審査委員会に係る標準業務手順書(第10版)【院内限定】
※臨床研究に係る標準業務手順書は臨床研究推進センターの「手順書・書類集」のページに掲載しています。【院内限定】
臨床研究に関する院内様式【院内のみ】
議事概要
議事概要
2023年度
2022年度
2021年度
2020年度
2019年度
問い合わせ
メール:rinken@kcho.jp
電話:078-302-5176
情報公開
情報公開文書
当院で実施する臨床研究において、患者さんの日常診療で得られた診療情報を研究に利用させていただくことがあります。
ご自身(ご家族を含む)のデータがこの研究に利用されることについて、異議がある場合は、情報の利用や他の研究機関への提供をいつでも停止することができます。研究の計画や内容などについて詳しくお知りになりたい方、ご自身のデータがこの研究で利用されることについて異議のある方、その他ご質問がある方は、各研究の情報公開文書に記載されている「問い合わせ先」へご連絡ください。なお、ご自身のデータを研究に使用することを拒否することにより、患者さんが不利益を受けることはありません。
情報公開(平成29年度以前)
倫理委員会について
倫理委員会 要綱はこちら(平成29年度以前)
委員名簿(平成29年度)
| 氏名 |
所属・職名 |
| 松田 睴 |
大阪大学名誉教授 |
| 丸山 英二 |
慶応義塾大学大学院健康マネジメント研究科特任教授 |
| 駿地 眞由美 |
追手門学院大学心理学部准教授 |
| 竹中 ナミ |
社会福祉法人プロップ・ステーション理事長 |
| 熊谷 保徳 |
神戸市保健福祉局健康部長 |
| 真𡽶和弘 |
神戸市立医療センター中央市民病院事務局長 |
| 内藤 泰 |
神戸市立医療センター中央市民病院副院長 |
| 坂井 信幸 |
神戸市立医療センター中央市民病院院長補佐兼脳神経外科部長 |
| 山森 みどり |
神戸市立医療センター中央市民病院院長補佐兼看護部長 |
| 橋田 亨 |
神戸市立医療センター中央市民病院院長補佐兼薬剤部長 |
神戸市立医療センター中央市民病院倫理委員会記録
- 開催日:平成29年12月19日(火)
- 開催場所:神戸市立医療センター中央市民病院2階特別会議室
| 課題名 |
健常者における[11C]チアミンの安全性と薬物動態の評価 |
| 申請者 |
千田 道雄 分子イメージンググループ長 |
| 出席委員名 |
松田 暉(委員長)、内藤 泰(副委員長)、丸山 英二、竹中 ナミ、
熊谷 保徳、真𡽶和弘、山森 みどり、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
| 課題名 |
滲出型加齢黄斑変性に対する自家iPS細胞由来網膜色素上皮(RPE)シート移植に関する臨床研究 |
| 申請者 |
栗本 康夫 神戸アイセンター病院長 |
| 出席委員名 |
松田 暉(委員長)、内藤 泰(副委員長)、丸山 英二、竹中 ナミ、
熊谷 保徳、真𡽶和弘、山森 みどり、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
| 課題名 |
滲出型加齢黄斑変性に対する自家iPS細胞由来網膜色素上皮(RPE)シート移植に関する臨床研究 |
| 申請者 |
栗本 康夫 神戸アイセンター病院長 |
| 出席委員名 |
松田 暉(委員長)、内藤 泰(副委員長)、丸山 英二、竹中 ナミ、
熊谷 保徳、真𡽶和弘、山森 みどり、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
| 課題名 |
緑内障患者のiPS 細胞由来網膜細胞の解析および遺伝子診断 |
| 申請者 |
栗本 康夫 神戸アイセンター病院長 |
| 出席委員名 |
松田 暉(委員長)、内藤 泰(副委員長)、丸山 英二、竹中 ナミ、
熊谷 保徳、真𡽶和弘、山森 みどり、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
| 課題名 |
網膜変性患者等のiPS細胞由来網膜細胞の解析、並びに同細胞を用いた網膜変性疾患治療法の研究 |
| 申請者 |
栗本 康夫 神戸アイセンター病院長 |
| 出席委員名 |
松田 暉(委員長)、内藤 泰(副委員長)、丸山 英二、竹中 ナミ、
熊谷 保徳、真𡽶和弘、山森 みどり、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
| 課題名 |
網膜変性疾患の遺伝子診断と自己免疫の検出 |
| 申請者 |
栗本 康夫 神戸アイセンター病院長 |
| 出席委員名 |
松田 暉(委員長)、内藤 泰(副委員長)、丸山 英二、竹中 ナミ、
熊谷 保徳、真𡽶和弘、山森 みどり、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
| 課題名 |
乳がん微小環境形成に関わる分子生物学的機序の生体試料を用いた探索研究」のため採取した血液検体を使っての「次世代における家族性乳がんの診療モデル構築のための基盤研究 |
| 申請者 |
加藤 大典 乳腺外科部長 |
| 出席委員名 |
松田 暉(委員長)、内藤 泰(副委員長)、丸山 英二、竹中 ナミ、
熊谷 保徳、真𡽶和弘、山森 みどり、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
継続審議 |
- 開催日:平成29年6月20日(火)
- 開催場所:神戸市立医療センター中央市民病院2階特別会議室
| 課題名 |
Japan CHARLOTTE:卵巣がんに対する横断研究:BRCA遺伝学検査に関する研究 |
| 申請者 |
吉岡 信也 産婦人科部長 |
| 出席委員名 |
松田 暉(委員長)、内藤 泰(副委員長)、丸山 英二、竹中 ナミ、
熊谷 保徳、真𡽶和弘、山森 みどり、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
条件付承認 |
| 課題名 |
ヒト疾患特異的iPS細胞の作成とそれを用いた疾患解析に関する研究 |
| 申請者 |
富井 啓介 呼吸器内科部長 |
| 出席委員名 |
松田 暉(委員長)、内藤 泰(副委員長)、丸山 英二、竹中 ナミ、
熊谷 保徳、真𡽶和弘、山森 みどり、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
継続審議 |
- 開催日:平成29年4月18日(火)
- 開催場所:神戸市立医療センター中央市民病院2階特別会議室
| 課題名 |
深部可視シースと排出機器を用いる低侵襲脳内血腫排出術の安全性と有効性に関する臨床研究 |
| 申請者 |
坂井 信幸 脳神経外科部長 |
| 出席委員名 |
松田 暉(委員長)、内藤 泰(副委員長)、丸山 英二、竹中 ナミ、
熊谷 保徳、真𡽶和弘、山森 みどり、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
| 課題名 |
特発性肺線維症における白血球テロメア長と血中バイオマーカーおよび臨床指標の関連についての検討 |
| 申請者 |
富井 啓介 呼吸器内科部長 |
| 出席委員名 |
松田 暉(委員長)、内藤 泰(副委員長)、丸山 英二、竹中 ナミ、
熊谷 保徳、坂井 信幸、真𡽶和弘、山森 みどり、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
- 開催日:平成29年3月14日(火)
- 開催場所:神戸市立医療センター中央市民病院2階特別会議室
| 課題名 |
骨髄不全患者を対象としたHLA-Aアレル欠失血球の検出 |
| 申請者 |
石川 隆之 血液内科部長 |
| 出席委員名 |
松田 暉(委員長)、内藤 泰(副委員長)、丸山 英二、駿地 眞由美、竹中 ナミ、
廣瀨 万希子、坂井 信幸、花田 裕之、山森 みどり、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
平成28年10月 神戸市立医療センター中央市民病院倫理委員会記録
- 開催日:平成28年10月18日(火)
- 開催場所:神戸市立医療センター中央市民病院2階特別会議室
| 課題名 |
固形がん組織の網羅的遺伝子変異解析 |
| 申請者 |
安井 久晃 腫瘍内科部長 |
| 出席委員名 |
松田 暉(委員長)、内藤 泰(副委員長)、駿地 眞由美、竹中 ナミ、
廣瀨 万希子、坂井 信幸、花田 裕之、山森 みどり、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
平成28年9月 神戸市立医療センター中央市民病院倫理委員会記録
- 開催日:平成28年9月13日(火)
- 開催場所:神戸市立医療センター中央市民病院2階特別会議室
| 課題名 |
急性期脳梗塞に対する血栓除去デバイス(T-01)を用いた治療の有効性及び安全性に関する多施設共同単群試験 |
| 申請者 |
坂井 信幸 脳神経外科部長 |
| 出席委員名 |
松田 暉(委員長)、内藤 泰(副委員長)、丸山 英二、駿地 眞由美、竹中 ナミ、
廣瀨 万希子、花田 裕之、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
平成28年7月 神戸市立医療センター中央市民病院倫理委員会記録
| 課題名 |
滲出型加齢黄斑変性(AMD)に対する他家iPS細胞由来網膜色素上皮(RPE)細胞懸濁液移植に関する臨床研究 |
| 申請者 |
栗本 康夫 眼科部長 |
| 出席委員名 |
松田 暉(委員長)、内藤 泰(副委員長)、丸山 英二、竹中 ナミ、
廣瀨 万希子、坂井 信幸、花田 裕之、髙屋 尚子、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
平成28年7月26日 承認 |
平成28年6月 神戸市立医療センター中央市民病院倫理委員会記録
- 開催日:平成28年6月14日(火)
- 開催場所:神戸市立医療センター中央市民病院2階特別会議室
| 課題名 |
滲出型加齢黄斑変性(AMD)に対する他家iPS細胞由来網膜色素上皮(RPE)細胞懸濁液移植に関する臨床研究 |
| 申請者 |
栗本 康夫 眼科部長 |
| 出席委員名 |
松田 暉(委員長)、内藤 泰(副委員長)、丸山 英二、竹中 ナミ、
廣瀨 万希子、花田 裕之、髙屋 尚子、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
継続審議 |
平成28年5月 神戸市立医療センター中央市民病院倫理委員会記録
- 開催日:平成28年5月6日(金)
- 開催場所:神戸市立医療センター中央市民病院1階講堂
| 課題名 |
多孔化カバードステント(NCVC-CS1)を用いた頭蓋内脳動脈瘤塞栓術の安全性及び機器の性能を評価する多施設共同単一群探索的試験 |
| 申請者 |
坂井 信幸 脳神経外科部長 |
| 出席委員名 |
松田 暉(委員長)、丸山 英二、廣瀨 万希子、花田 裕之、髙屋 尚子、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
| 課題名 |
膵癌・乳癌・卵巣癌・前立腺癌いずれかの家族歴を有する、または、乳癌・卵巣癌・前立腺癌いずれかの既往歴を有する、遠隔転移を伴う膵癌を対象としたゲムシタビン/オキサリプラチン療法(GEMOX療法)の多施設共同第II相試験(FABRIC study)附随研究 家族歴を有する膵癌患者における生殖細胞系列変異に関する研究 |
| 申請者 |
辻 晃仁 腫瘍内科参事 |
| 出席委員名 |
松田 暉(委員長)、丸山 英二、廣瀨 万希子、坂井 信幸、花田 裕之、髙屋 尚子、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
| 課題名 |
臍帯血移植後に発症した臍帯血由来一過性異常骨髄増殖症に対する遺伝子解析 |
| 申請者 |
石川 隆之 血液内科部長 |
| 出席委員名 |
松田 暉(委員長)、丸山 英二、廣瀨 万希子、坂井 信幸、花田 裕之、髙屋 尚子、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
平成27年10月 神戸市立医療センター中央市民病院倫理委員会記録
- 開催日:平成27年10月20日(火)
- 開催場所:神戸市立医療センター中央市民病院2階特別会議室
| 課題名 |
緑内障患者のiPS (induced pluripotent stem) 細胞由来網膜細胞の解析および遺伝子診断 |
| 申請者 |
栗本 康夫 眼科部長 |
| 出席委員名 |
松田 暉(委員長)、内藤 泰(副委員長)、丸山 英二、駿地 眞由美、竹中 ナミ、花田 裕之、髙屋 尚子、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
| 課題名 |
先天性血小板減少症の診断ガイドライン作成に関する研究 |
| 申請者 |
石川 隆之 血液内科部長 |
| 出席委員名 |
松田 暉(委員長)、内藤 泰(副委員長)、丸山 英二、駿地 眞由美、竹中 ナミ、花田 裕之、髙屋 尚子、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
平成27年8月 神戸市立医療センター中央市民病院倫理委員会記録
- 開催日:平成27年8月18日(火)
- 開催場所:神戸市立医療センター中央市民病院2階特別会議室
| 課題名 |
固形腫瘍における遺伝子異常の網羅的解析 |
| 申請者 |
猪熊 哲朗 消化器内科部長 |
| 出席委員名 |
松田 暉(委員長)、内藤 泰(副委員長)、丸山 英二、竹中 ナミ、廣瀨 万希子、花田 裕之、髙屋 尚子、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
| 課題名 |
造血器悪性腫瘍における遺伝子異常の網羅的解析 |
| 申請者 |
石川 隆之 血液内科部長 |
| 出席委員名 |
松田 暉(委員長)、内藤 泰(副委員長)、丸山 英二、竹中 ナミ、廣瀨 万希子、花田 裕之、髙屋 尚子、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
平成27年6月 神戸市立医療センター中央市民病院倫理委員会記録
- 開催日:平成27年6月29日(火)
- 開催場所:神戸市立医療センター中央市民病院2階特別会議室
| 課題名 |
日本人の加齢黄斑変性におけるHLAの遺伝子型の特徴 |
| 申請者 |
栗本 康夫 眼科部長 |
| 出席委員名 |
松田 暉(委員長)、内藤 泰(副委員長)、駿地 眞由美、竹中 ナミ、廣瀨 万希子、花田 裕之、髙屋 尚子、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
| 課題名 |
脳死下における臓器提供時の脳死判定医の選定について |
| 申請者 |
林 卓郎 臓器提供対策室長 |
| 出席委員名 |
松田 暉(委員長)、内藤 泰(副委員長)、駿地 眞由美、竹中 ナミ、廣瀨 万希子、花田 裕之、髙屋 尚子、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
平成27年2月 神戸市立医療センター中央市民病院倫理委員会記録
- 開催日:平成27年2月17日(火)
- 開催場所:神戸市立医療センター中央市民病院2階特別会議室
| 課題名 |
成人T細胞白血病/リンパ腫における腫瘍性増殖機構の解析 |
| 申請者 |
石川 隆之 血液内科部長 |
| 出席委員名 |
福井 有公(委員長)、石原 隆(副委員長)、丸山 英二、駿地 眞由美、竹中 ナミ、廣瀨 万希子、花田 裕之、坂井 信幸、髙屋 尚子、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
| 課題名 |
自己免疫性肺胞蛋白症の遺伝素因に関する研究 |
| 申請者 |
富井 啓介 呼吸器内科部長 |
| 出席委員名 |
福井 有公(委員長)、石原 隆(副委員長)、丸山 英二、駿地 眞由美、竹中 ナミ、廣瀨 万希子、花田 裕之、坂井 信幸、髙屋 尚子、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
平成26年12月 神戸市立医療センター中央市民病院倫理委員会記録
- 開催日:平成26年12月16日(火)
- 開催場所:神戸市立医療センター中央市民病院2階特別会議室
| 課題名 |
培養自家口腔粘膜上皮シート製造に使用する羊膜基質の製造及び品質管理工程に関する検討 |
| 申請者 |
吉岡 信也 産婦人科部長 |
| 出席委員名 |
福井 有公(委員長)、石原 隆(副委員長)、丸山 英二、竹中 ナミ、花田 裕之、髙屋 尚子、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
| 課題名 |
臓器提供マニュアルの改訂及び脳死判定医の選定について |
| 申請者 |
渥美 生弘 臓器提供対策室長 |
| 出席委員名 |
福井 有公(委員長)、石原 隆(副委員長)、丸山 英二、竹中 ナミ、花田 裕之、髙屋 尚子、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
平成26年10月 神戸市立医療センター中央市民病院倫理委員会記録
- 開催日:平成26年10月21日(火)
- 開催場所:神戸市立医療センター中央市民病院2階特別会議室
| 課題名 |
特発性間質性肺炎における原因遺伝子異常の解明 |
| 申請者 |
富井 啓介 呼吸器内科部長 |
| 出席委員名 |
福井 有公(委員長)、石原 隆(副委員長)、丸山 英二、廣瀨 万希子、花田 裕之、坂井 信幸、髙屋 尚子、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
平成26年8月 神戸市立医療センター中央市民病院倫理委員会記録
- 開催日:平成26年8月19日(火)
- 開催場所:神戸市立医療センター中央市民病院2階特別会議室
| 課題名 |
抗Factor H抗体の測定と原因遺伝子の解析 |
| 申請者 |
石川 隆之 血液内科部長 |
| 出席委員名 |
福井 有公(委員長)、石原 隆(副委員長)、丸山 英二、駿地 眞由美、竹中 ナミ、花田 裕之、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
| 課題名 |
家族性・若年性の癌及び遺伝性腫瘍に関する診断と研究 |
| 申請者 |
坂井 信幸 脳神経外科部長 |
| 出席委員名 |
福井 有公(委員長)、石原 隆(副委員長)、丸山 英二、駿地 眞由美、竹中 ナミ、花田 裕之、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
| 課題名 |
患者が治療等を拒否した際の対応について |
| 申請者 |
有吉 孝一 救急部長 |
| 出席委員名 |
福井 有公(委員長)、石原 隆(副委員長)、丸山 英二、駿地 眞由美、竹中 ナミ、花田 裕之、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
平成26年6月 神戸市立医療センター中央市民病院倫理委員会記録
- 開催日:平成26年6月17日(火)
- 開催場所:神戸市立医療センター中央市民病院2階特別会議室
| 課題名 |
「進行膵癌を対象としたゲムシタビン+エルロチニブ併用療法における間質性肺疾患発症に関与する遺伝子多型の解析と、治療効果、有効性及び安全性の評価」の報告 |
| 申請者 |
辻 晃仁 腫瘍内科部長 |
| 出席委員名 |
福井 有公(委員長)、石原 隆(副委員長)、丸山 英二、竹中 ナミ、花田 裕之、髙屋 尚子、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
| 課題名 |
脳死下臓器提供について |
| 申請者 |
渥美 生弘 臓器提供対策室長 |
| 出席委員名 |
福井 有公(委員長)、石原 隆(副委員長)、丸山 英二、竹中 ナミ、花田 裕之、髙屋 尚子、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
| 課題名 |
脳死判定医の選定について |
| 申請者 |
渥美 生弘 臓器提供対策室長 |
| 出席委員名 |
福井 有公(委員長)、石原 隆(副委員長)、丸山 英二、竹中 ナミ、花田 裕之、髙屋 尚子、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
平成25年12月 神戸市立医療センター中央市民病院倫理委員会記録
- 開催日:平成25年12月17日(火)
- 開催場所:神戸市立医療センター中央市民病院2階特別会議室
| 課題名 |
骨髄異形成症候群(MDS)を対象としたFF10501-01の臨床第Ⅰ相試験及び継続投与試験 |
| 申請者 |
石川 隆之 血液内科部長 |
| 出席委員名 |
福井 有公(委員長)、石原 隆(副委員長)、丸山 英二、竹中 ナミ、
清水 義一、稲 恒子、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
平成25年6月 神戸市立医療センター中央市民病院倫理委員会記録
- 開催日:平成25年6月18日(火)
- 開催場所:神戸市立医療センター中央市民病院2階特別会議室
| 課題名 |
進行膵癌を対象としたゲムシタビン+エルロチニブ併用療法における間質性肺疾患発症に関与する遺伝子多型の解析と、治療効果、有効性及び安全性の評価 |
| 申請者 |
辻 晃仁 腫瘍内科部長 |
| 出席委員名 |
福井 有公(委員長)、石原 隆(副委員長)、丸山 英二、駿地 眞由美、竹中 ナミ、
、宮本 一郎、清水 義一、稲 恒子、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
平成25年2月 神戸市立医療センター中央市民病院倫理委員会記録
- 開催日:平成25年2月19日(火)
- 開催場所:神戸市立医療センター中央市民病院2階特別会議室
| 課題名 |
滲出型加齢黄斑変性に対する自家iPS細胞由来網膜色素上皮(RPE)シート移植に関する臨床研究 |
| 申請者 |
栗本 康夫 眼科部長 |
| 出席委員名 |
福井 有公(委員長)、石原 隆(副委員長)、丸山 英二、竹中 ナミ、
清水 義一、稲 恒子、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
平成24年10月 神戸市立医療センター中央市民病院倫理委員会記録
- 開催日:平成24年10月16日(火)
- 開催場所:神戸市立医療センター中央市民病院2階特別会議室
| 課題名 |
子宮内膜癌Ⅰ期症例に対する腹腔鏡下骨盤リンパ節郭清術および腹腔鏡下単純子宮全摘術の実施 |
| 申請者 |
北 正人 産婦人科部長 |
| 出席委員名 |
福井 有公(委員長)、石原 隆(副委員長)、丸山 英二、駿地 眞由美、
竹中 ナミ、清水 義一、稲 恒子、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
| 課題名 |
脳血管疾患の再発に対する高脂血症治療薬HMG-CoA還元酵素阻害薬の予防効果の遺伝子背景に関する研究 -J-STARS Genomics- |
| 申請者 |
幸原 伸夫 神経内科部長 |
| 出席委員名 |
福井 有公(委員長)、石原 隆(副委員長)、丸山 英二、駿地 眞由美、
竹中 ナミ、清水 義一、稲 恒子、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
- 迅速審査結果報告として、すでに倫理委員会で承認済みの『急性高度難聴患者に対する生体吸収性徐放ゲルを用いたリコンビナント・ヒト・インスリン様細胞成長因子1の内耳投与による感音難聴治療のランダム化対照試験』の一部変更が承認されたことが報告された。
- 迅速審査結果報告として、すでに倫理委員会で承認済みの『急性期心原性脳塞栓症患者に対する自己骨髄単核球静脈内投与に関する臨床研究』の一部変更が承認されたことが報告された。
- 『倫理委員会要綱』の一部変更を審議し、承認された。
平成24年8月 神戸市立医療センター中央市民病院倫理委員会記録
- 開催日:平成24年8月21日(火)
- 開催場所:神戸市立医療センター中央市民病院2階特別会議室
| 課題名 |
各種シグナル伝達病におけるプロテオーム・メタボローム解析と関連遺伝子発現・遺伝子多型に関する検討 |
| 申請者 |
長野 徹 皮膚科部長 |
| 出席委員名 |
福井 有公(委員長)、石原 隆(副委員長)、丸山 英二、竹中 ナミ、
宮本 一郎、清水 義一、稲 恒子、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
| 課題名 |
IgG4関連疾患・自己免疫性膵炎における疾患関連遺伝子の解析 |
| 申請者 |
猪熊 哲朗 消化器内科部長 |
| 出席委員名 |
福井 有公(委員長)、石原 隆(副委員長)、丸山 英二、竹中 ナミ、
宮本 一郎、清水 義一、稲 恒子、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
| 課題名 |
C型肝炎ウイルスに起因する肝硬変患者に対する自己骨髄細胞投与療法の有効性と安全性に関する研究 |
| 申請者 |
猪熊 哲朗 消化器内科部長 |
| 出席委員名 |
福井 有公(委員長)、石原 隆(副委員長)、丸山 英二、竹中 ナミ、
宮本 一郎、清水 義一、稲 恒子、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
平成24年6月 神戸市立医療センター中央市民病院倫理委員会記録
- 開催日:平成24年6月19日(火)
- 開催場所:神戸市立医療センター中央市民病院2階特別会議室
| 課題名 |
BRCA1遺伝子変異をもつ女性に対する、卵巣癌(および子宮体癌)発症予防のための卵巣卵管切除術(および子宮全摘出術) |
| 申請者 |
北 正人 産婦人科部長 |
| 出席委員名 |
福井 有公(委員長)、石原 隆(副委員長)、丸山 英二、駿地 眞由美、
竹中 ナミ、宮本 一郎、清水 義一、坂井 信幸、稲 恒子、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
平成24年4月 神戸市立医療センター中央市民病院倫理委員会記録
- 開催日:平成24年4月17日(火)
- 開催場所:神戸市立医療センター中央市民病院2階特別会議室
| 課題名 |
高度内耳奇形に対するCI422型人工内耳の臨床応用 |
| 申請者 |
内藤 泰 耳鼻咽喉科部長 |
| 出席委員名 |
福井 有公(委員長)、石原 隆(副委員長)、丸山 英二、駿地 眞由美、
宮本 一郎、清水 義一、坂井 信幸、稲 恒子、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
| 課題名 |
CO₂専用アダプターの製作 |
| 申請者 |
山崎 和夫 麻酔科・中央手術部部長 |
| 出席委員名 |
福井 有公(委員長)、石原 隆(副委員長)、丸山 英二、駿地 眞由美、
宮本 一郎、清水 義一、坂井 信幸、稲 恒子、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
平成23年11月 神戸市立医療センター中央市民病院倫理委員会記録
- 開催日:平成23年11月1日(火)
- 開催場所:神戸市立医療センター中央市民病院2階特別会議室
| 課題名 |
Surpass NeuroEndoGraft System を用いた脳血管内治療 |
| 申請者 |
坂井 信幸 脳神経外科部長 |
| 出席委員名 |
福井 有公(委員長)、丸山 英二、宮本 一郎、松添 雄介、、中野 悦子、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
迅速審査結果報告として、すでに倫理委員会で承認済みの『急性期心原性脳塞栓患者に対する自己骨髄単核球静脈内投与に関する臨床研究』の一部変更が承認されたことが報告された。
平成23年6月 神戸市立医療センター中央市民病院倫理委員会記録
- 開催日:平成23年6月21日(火)
- 開催場所:神戸市立医療センター中央市民病院5階503会議室
| 課題名 |
急性高度難聴患者に対する生体吸収性徐放ゲルを用いたリコンビナント・ヒト・インスリン様細胞成長因子1の内耳投与による感音難聴治療のランダム化対照試験 |
| 申請者 |
内藤 泰 耳鼻咽喉科部長 |
| 出席委員名 |
福井 有公(委員長)、石原 隆(副委員長)、丸山 英二、竹中 ナミ、松添 雄介、
坂井 信幸、中野 悦子、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
平成23年4月 神戸市立医療センター中央市民病院倫理委員会記録
- 開催日:平成23年4月19日(火)
- 開催場所:神戸市立医療センター中央市民病院5階503会議室
| 課題名 |
遺伝学的クロピドグレル抵抗性の臨床的意義に関する研究 |
| 申請者 |
坂井 信幸 脳神経外科部長 |
| 出席委員名 |
福井 有公(委員長)、石原 隆(副委員長)、丸山 英二、竹中 ナミ、宮本 一郎、
松添 雄介、中野 悦子、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
| 課題名 |
急性期心原性脳塞栓症患者に対する自己骨髄単核球静脈内投与に関する臨床研究 |
| 申請者 |
坂井 信幸 脳神経外科部長 |
| 出席委員名 |
福井 有公(委員長)、石原 隆(副委員長)、丸山 英二、竹中 ナミ、宮本 一郎、
松添 雄介、中野 悦子、橋田 亨、石川 隆之 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
| 課題名 |
HDR症候群の遺伝子診断 |
| 申請者 |
鈴木 隆夫 腎臓内科部長 |
| 出席委員名 |
福井 有公(委員長)、石原 隆(副委員長)、丸山 英二、竹中 ナミ、宮本 一郎、
松添 雄介、中野 悦子、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
平成23年2月 神戸市立医療センター中央市民病院倫理委員会記録
開催日:平成23年2月15日(火)開催場所:神戸市立医療センター中央市民病院5階503会議室
| 課題名 |
骨切り、骨螺子挿入用カスタムガイドの開発 |
| 申請者 |
川那辺 圭一 整形外科部長 |
| 出席委員名 |
福井 有公(委員長)、石原 隆(副委員長)、丸山 英二、竹中 ナミ、大下 勝、
松添 雄介、坂井 信幸、中野 悦子、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
平成22年10月 神戸市立医療センター中央市民病院倫理委員会記録
- 開催日:平成22年10月19日(火)
- 開催場所:神戸市立医療センター中央市民病院5階503会議室
| 課題名 |
改訂臓器提供マニュアルと脳死判定医の承認を求める件について |
| 申請者 |
佐藤 愼一 臓器提供対策室長 |
| 出席委員名 |
福井 有公(委員長)、石原 隆(副委員長)、丸山 英二、駿地 眞由美、
竹中 ナミ、大下 勝、松添 雄介、中野 悦子、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
迅速審査結果報告として、すでに倫理委員会で承認済みの『急性心筋梗塞患者を対象とした自家末梢血血管内皮前駆細胞(CD34陽性細胞)冠動脈内注入による血管再生治療に関する第Ⅰ-Ⅱ相試験について』の一部変更が承認されたことが報告された。
平成22年8月 神戸市立医療センター中央市民病院倫理委員会記録
- 開催日:平成22年8月17日(火)
- 開催場所:神戸市立医療センター中央市民病院5階503会議室
| 課題名 |
『大腸腫瘍に対する内視鏡的粘膜下層剥離術(ESD)』の先進医療(既評価技術)としての実施開始について |
| 申請者 |
猪熊 哲朗 消化器内科部長 |
| 出席委員名 |
福井 有公(委員長)、石原 隆(副委員長)、丸山 英二、竹中 ナミ、
大下 勝、松添 雄介、中野 悦子、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
平成22年4月 神戸市立医療センター中央市民病院倫理委員会記録
- 開催日:平成22年4月20日(火)
- 開催場所:神戸市立医療センター中央市民病院5階503会議室
| 課題名 |
白内障および早期加齢黄斑変性の病因遺伝子に関する研究 |
| 申請者 |
栗本 康夫 眼科部長 |
| 出席委員名 |
福井 有公(委員長)、石原 隆(副委員長)、丸山 英二、駿地 眞由美、
竹中 ナミ、大下 勝、松添 雄介、中野 悦子、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
| 課題名 |
吸入ステロイド治療下喘息患者における呼吸機能低下と遺伝子多型との関連 |
| 申請者 |
富井 啓介 呼吸器内科部長 |
| 出席委員名 |
福井 有公(委員長)、石原 ¥隆(副委員長)、丸山 英二、駿地 眞由美、
竹中 ナミ、大下 勝、松添 雄介、中野 悦子、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
平成21年10月 神戸市立医療センター中央市民病院倫理委員会記録
- 開催日:平成21年10月20日(火)
- 開催場所:神戸市立医療センター中央市民病院5階503会議室
| 課題名 |
iPS細胞を用いた遺伝性内耳性難聴病態の解析 |
| 申請者 |
内藤 泰 副院長(耳鼻咽喉科部長兼務) |
| 出席委員名 |
福井 有公(委員長)、高橋 隆幸(副委員長)、丸山 英二、竹中 ナミ、大下 勝、
藤木 暢也、雪村 新之助、中野 悦子、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
平成21年8月 神戸市立医療センター中央市民病院倫理委員会記録
- 開催日:平成21年8月20日(火)
- 開催場所:神戸市立医療センター中央市民病院5階503会議室
| 課題名 |
遺伝学的クロピドグレル抵抗性の臨床的意義に関する研究 |
| 申請者 |
坂井 信幸 脳神経外科部長 |
| 出席委員名 |
福井 有公(委員長)、高橋 隆幸(副委員長)、丸山 英二、
駿地 眞由美、大下 勝、雪村 新之助、中野 悦子、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
| 課題名 |
先天性難聴の遺伝子診断 |
| 申請者 |
内藤 泰 副院長(耳鼻咽喉科部長兼務) |
| 出席委員名 |
福井 有公(委員長)、高橋 隆幸(副委員長)、丸山 英二、駿地 眞由美、
坂井 信幸、大下 勝、雪村 新之助、中野 悦子、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
平成21年6月 神戸市立医療センター中央市民病院倫理委員会記録
- 開催日:平成21年6月16日(火)
- 開催場所:神戸市立医療センター中央市民病院5階503会議室
| 課題名 |
急性心筋梗塞患者を対象とした自家抹消血血管内皮前駆細胞CD34陽性細胞)冠動脈内注入による血管再生治療に関する第Ⅰ-Ⅱ相試験 |
| 申請者 |
古川 裕 循環器内科部長 |
| 出席委員名 |
福井 有公(委員長)、高橋 隆幸(副委員長)、丸山 英二、駿地 眞由美、
竹中 ナミ、盛岡 茂文、坂井 信幸、大下 勝、雪村 新之助、中野 悦子、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
| 課題名 |
フィラデルフィア染色体陽性の急性リンパ性白血病に対する無症候性甲状腺機能低下症のsibling donorよりの同種移植 |
| 申請者 |
高橋 隆幸 院長代行(血液内科部長兼務) |
| 出席委員名 |
福井 有公(委員長)、丸山 英二、駿地 眞由美、竹中 ナミ、大下 勝、
雪村 新之助、中野 悦子、橋田 亨 |
| 審議内容 |
申請内容について、倫理的、社会的配慮のもとに実施されるかを審議した。 |
| 審議結果 |
承認 |
| 課題名 |
脳死判定医の補充について |
| 申請者 |
佐藤 愼一 救急部長 |
| 出席委員名 |
福井 有公(委員長)、丸山 英二、駿地 眞由美、竹中 ナミ、大下 勝、
雪村 新之助、中野 悦子、橋田 亨 |
| 審議内容 |
人事異動に伴い補充する脳死判定医の適否を審議した。 |
| 審議結果 |
承認 |
受託研究審査委員会
受託研究審査委員会について
受託研究審査委員会では、医薬品、医療機器および再生医療等製品の製造販売後調査等のうち、使用成績調査(一般使用成績調査、特定使用成績調査、使用成績比較調査)を当院で実施することの適否を審査します。
開催日時
2024年度
| 開催月 |
提出書類
締切日 |
開催日 |
| 4月 |
3月22日 |
4月8日(月) |
| 5月 |
4月24日 |
5月13日(月)★ |
| 6月 |
5月24日 |
6月10日(月) |
| 7月 |
6月21日 |
7月8日(月) |
| 8月 |
7月26日 |
8月19日(月)★ |
| 9月 |
8月23日 |
9月9日(月) |
| 10月 |
9月27日 |
10月21日(月)★ |
| 11月 |
10月25日 |
11月11日(月) |
| 12月 |
11月22日 |
12月9日(月) |
| 1月 |
12月27日 |
2025年1月20日(月)★ |
| 2月 |
1月24日 |
2月10日(月) |
| 3月 |
2月21日 |
3月10日(月) |
※毎月第2月曜日に開催されますが、★印の月は第3月曜日に開催されます。
17:00〜18:00 本館2F特別会議室
申請手順 ※新型コロナウィルス感染症関連のお知らせあり(2020年3月9日)
はじめに
- 申請可能な品目は、原則として当院採用品(院外専用医薬品含む)、要時購入品で全例調査等特段の事由がある品目となります。
- 受託研究審査委員会で承認され、契約締結後に調査開始となります。委員会は原則、毎月第2月曜日(祝日の場合は第3月曜日)が開催日です。毎月25日(25日が非営業日の場合は、直前の最終営業日)までに受領した案件を、次月の委員会に諮ります。
- 全例調査(承認条件等当局に指示されたもの)の品目については、当院規定により迅速審査が可能です。詳細はご相談ください。
- 製造販売後調査ではCRCによる支援はありません。実施可能性については十分に実施診療科医師とご相談ください。
新規申請から調査終了までの流れ
現在、ヒアリング及び申請・審査資料提出は原則リモート(メール等)で実施しておりますので、以下のとおりご対応をお願いいたします。
●「ヒアリング時に必要な資料」(各1部)を添付してe-mailにてご依頼ください。
●「①で作成した書式」については、wordまたはexcel形式にてお送りください。
●「③ヒアリング実施」についても原則リモート(メール等)で実施しておりますので、候補日程のご提示は不要です。
●「④申請・審査資料」に記載の各資料(ヒアリング後に確定した資料)は、すべてpdf形式で、e-mailにて提出してください。
①申請書類の作成
様式第1号、様式第3号および様式第10号を作成してください。
様式等の雛型は下記よりダウンロードできます。
②ヒアリング依頼(日程調整)
現在、申請・審査資料の確認は原則メール等で実施しております。
- ヒアリングの日程調整を、電話又はe-mailにてご依頼ください。候補日時は複数挙げてください。
お申込み先:
電話:078-302-4321(代表)、臨床研究推進センター宛にご用件を「新規製造販売後調査ヒアリングの申し込み」とお伝えください。
e-mail:chiken@kcho.jp、タイトルに「【新規申請】薬剤(機器)名製造販売後調査ヒアリングの申し込み」と明記してください。
- ヒアリング時に必要な資料:
- 実施要綱、調査票見本、添付文書、①で作成した様式・・・各2部
- 製品概要、インタビューフォーム・・・各1部
③ヒアリング実施
- 上記「ヒアリング時に必要な資料」をご用意のうえ、直接、南館4階の臨床研究推進センターへお越しください。
- 対応者は、センタースタッフ1~2名です。
- 内容は、実施要綱の確認、申請書類の確認等で約15~30分です。
④申請・審査資料提出
現在、申請・審査資料の確認は原則メール等で実施しております。
- 以下の審査資料を郵送又は持参でご提出ください:
- 上記で確定した申請書類・・・各1部
- 実施要綱、添付文書・・・各25部
(迅速審査の場合は、実施要綱、添付文書、各1部)
- 毎月25日(25日が非営業日の場合は、直前の最終営業日)までに受領した案件を、次月の委員会に諮ります。
⑤委員会審査
- 原則、毎月第2月曜日(祝日の場合は第3月曜日)が委員会開催日となります。
- 委員会での説明は、研究責任医師となります。依頼者様の同席は不要です。
- 後日、審査結果通知書を依頼者様・研究責任医師宛に発行します。
⑥契約
- 委員会承認後は、契約締結となります。
- 契約書は当院様式を基本としますが、文言追加等のご要望がある場合は、お申し出ください。
⑦調査開始
- 契約締結後に調査が開始可能となります。
- 実施中は、年1回の継続申請が必要です。(⑧をご参照ください。)
- 研究費は、実績に応じてご請求させていただきます。(調査票表紙の写しと費用請求依頼書を臨床研究推進センター宛にご提出ください。)
⑧継続申請(年1回)、研究責任医師の変更、契約期間変更、症例数追加の申請
- 継続審査のご申請は、⑤の初回審査月の前月25日(25日が非営業日の場合は、直前の最終営業日)までに様式第4号をご提出ください。
※ご申請がない場合、継続して研究ができません。
- 研究責任医師の変更、契約期間変更、症例数追加がある場合は、申請・届出が必要です。所定の書式を作成のうえ、臨床研究推進センター宛に宛ご連絡ください。
⑨終了/中止報告
- 研究の終了・中止時は、必ず様式第7号でご報告ください。ご提出がないとその間の事務経費がかかることがあります。
手順書・様式一覧
GPSP省令
GPSP省令についてはこちら
標準業務手順書
神戸市立医療センター中央市民病院 受託研究(使用成績調査)に係る標準業務手順書(第4版)
各種様式一覧