当院での治験・臨床研究の取り組み
当院での治験・臨床研究の取り組み
当院は神戸市の基幹病院として市民の生命と健康を守るため、患者さん中心の質の高い医療を安全に提供することを基本理念に掲げ、高度・先進医療や24時間365日体制の救急医療を提供し、市民の皆様の要請に応えることを基本方針としています。
このように様々な患者さんが集まる当院では、“より安全で、より有効な”医薬品を、より早く患者の皆様にお届けできるよう、新薬の開発に貢献するための治験を積極的に受託、実施しています。また、より良い治療法を確立するための質の高い臨床研究の実施にも取り組んでおり、それらの成果を医療の質および安全性の向上に繋げることで社会に還元することを目指しています。
実施中の治験一覧治験・臨床研究に関する患者相談窓口
〒650-0047
神戸市中央区港島南町2丁目1番地1
臨床研究推進センター
TEL:(078)302-4448 ※電話応対は平日9:00〜17:00
FAX:(078)302-4604
メール:c_ccri1あっとkcho.jp
※迷惑メール対策のため、メールアドレスの あっと は@に置き換えてください。
治験依頼者からの治験に関する連絡先
TEL:078-302-4499 ※電話応対は平日9:00~17:00
Mail:c_ccriあっとkcho.jp
※迷惑メール対策のため、メールアドレスの あっと は@に置き換えてください。
研究者・企業からの臨床研究に関する連絡先
TEL:078-302-4499 ※電話応対は平日9:00~17:00
Mail:rinkenあっとkcho.jp
※迷惑メール対策のため、メールアドレスの あっと は@に置き換えてください。
研究者・企業からの特定臨床研究に関する連絡先
TEL:078-302-4499 ※電話応対は平日9:00~17:00
Mail:c_tokuteiあっとkcho.jp
※迷惑メール対策のため、メールアドレスの あっと は@に置き換えてください。
製造販売後調査全般の窓口
TEL:078-302-4499 ※電話応対は平日9:00~17:00
Mail:chikenあっとkcho.jp
※迷惑メール対策のため、メールアドレスの あっと は@に置き換えてください。
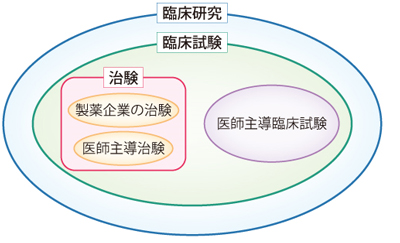
臨床研究・治験とは
臨床研究とは
病気の原因や進行のしくみを解明、病気の予防・診断・治療の改善、患者さんの生活の質の向上などのために行う医学的な研究で、人を対象としておこなわれます。
「臨床研究」のうち、治療や指導などの介入を行って、その結果を評価するものを「臨床試験」といいます。その中でも、医師が研究者として主体的に行うものを「医師主導臨床試験」といいます。これまで厚生労働省で承認された薬、治療法や診断法から最良の治療法や診断法を確立すること、薬のよりよい組み合わせを確立すること等を目的としています。
治験とは
「治験」とは、厚生労働省から新薬としての承認を得ることを目的とし、未承認薬・適応外薬を用いて主に製薬企業が行う臨床試験です。これまで患者さんに使用されたことのない新しい薬やその疾患では使用されたことのない薬の安全性(副作用などはどうか)や有効性(効果の有無)を調べます。治験から得られた結果をもとに、厚生労働省からの承認が得られると、製薬会社が薬を販売し、多くの患者さんに使用されるようになります。「治験」には、医師が自ら実施する治験もあり、「医師主導治験」と呼んで製薬会社が行う治験と区別しています。
治験への参加について
治験への参加は決して強制的なものではありません。治験への参加決定は、内容を十分にご理解頂いた後でお決めください。参加をするかしないかはご本人の自由意思で決めることができます。
治験への参加は、治験担当医師や臨床研究(治験)コーディネーター※から、参加する治験の目的、方法、治験に参加する期間、治験薬の性質、用法・用量、治験期間中の注意点などの説明が詳しく行われます。不明な点がある場合は、治験担当医師や臨床研究(治験)コーディネーターから納得のいくまで繰り返し説明を受けることができます。
※臨床研究(治験)コーディネーターとは
臨床研究(治験)コーディネーターとは、治験に参加する患者さん(被験者)の人権や安全性を守り、科学性、信頼性の高い治験を円滑に進められるように管理・調整する専門スタッフのことです。CRC(Clinical Research Coordinator)とも呼ばれ、患者さんには、いつでも安心して治験に参加して頂けるよう、治験期間中の相談窓口になります。またスケジュールの管理や来院調整など調整役を担っています。患者さんには、治験に関してわからないことや悩んでいることなどを、CRCに気軽に相談していただき、十分納得されるまで説明を行っています。
治験のルール
治験では、「くすりの候補」を人に使っていただくことになるため、「くすりの候補」の有効性や安全性を科学的な方法で正確に調べると同時に、治験に参加していただく方の人権や安全が最大限に守られなければなりません。
そのため、治験の実施に関して、大変厳格なルールが国によって定められています。そのルールは、「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」(医療品医療機器等法)という法律と厚生労働省が定めた「医薬品の臨床試験の実施の基準に関する省令」(Good Clinical Practice:GCP) で、治験を行う企業、病院、医師等はこの規則を守らなければなりません。
<<医療品医療機器等法・GCPで定められている主なルール>>
治験の内容を国に届け出ること
製薬会社は、治験を担当する医師が合意した「治験実施計画書」を厚生労働省に届け出なければなりません。厚生労働省は、この内容を調査し、問題があれば変更等の指示を出します。
治験審査委員会
治験の依頼を受けた病院は治験審査委員会を設置し、「治験実施計画書」が治験に参加される患者さんの人権と福祉を守って治験薬の有効性を科学的に調べられる計画になっているか、安全性に問題がないか、患者さんへの説明文書は分かりやすい内容であるか等を審査しなければなりません。その委員会に医師のほかに、法律家など医療以外の専門家等(一般の方の場合もあります)が必ず参加します。
インフォームド コンセント
治験担当医師は、治験に参加される患者さんに対して、治験の目的、方法、期待される効果、予測される副作用などの不利益、治験参加されない場合の治療法などを説明文書で説明し、患者さんご本人の自由意思による治験参加の同意を文書にて得なければなりません。
重大な副作用発生時
治験中に発生したこれまでに知られていない重大な副作用は治験を依頼した製薬会社から国に報告され、参加されている患者さんの安全を確保するため必要に応じて治験計画の見直しなどが行われます。
健康被害に対する補償
万が一、治験が原因で何らかの障害や病気などの健康被害があった場合は、適切な治療と補償が受けられます。
製薬会社による確認
治験を依頼した製薬会社の担当者は、治験を実施している医療機関で治験の進行を調査し、「治験実施計画書」やGCPの規則を守って適正に行われていることを確認しなければなりません。
医薬品が誕生するまで
実施中の治験一覧
当院で実施する治験および製造販売後臨床試験は、当院に設置された治験審査委員会で審査を受け、承認されています。治験審査委員会では、医学・薬学の専門家および非専門家、ならびに当院と利害関係のない者から成る委員で、試験の内容や当院で実施することの妥当性について、倫理的・科学的観点で審議されています。
実施中の治験についてのお問い合わせは下記の窓口へお願いいたします。
治験・臨床研究に関する相談窓口
〒650-0047
神戸市中央区港島南町2丁目1番地1
臨床研究推進センター
TEL:(078)302-4448 ※電話応対は平日9:00〜17:00
FAX:(078)302-4604
メール:c_ccri1あっとkcho.jp
※迷惑メール対策のため、メールアドレスの あっと は@に置き換えてください。
新たに始まった治験の一覧
| 診療科 | 課題名 / 試験名 | 備考 |
|---|---|---|
| 腫瘍内科 | 未治療のdMMR/MSI-H を有する切除可能な結腸癌患者を対象としたdostarlimab の第III 相試験 | |
| HER2陽性転移性胃食道腺癌患者を対象としたZanidatamabとの化学療法併用の第Ⅲ相試験 | ||
| 胃がんを対象としたONO-4578の第Ⅱ相試験 | ||
| 循環器内科 | Fontaine分類Ⅲ及びⅣ度の下肢閉塞性動脈硬化症の患者を対象にしたEIM-001の下肢筋肉内投与による二重盲検ランダム化比較試験 | 医師主導治験 |
| 血液内科 | 同種造血細胞移植(同種HCT)を受ける急性骨髄性白血病(AML)患者に対する補助療法及び維持療法としてのMocravimodの有効性及び安全性を評価するための前向き、ランダム化、二重盲検、プラセボ対照、多施設共同第III 相試験 | |
| Expanded Access Study for the Treatment of Patients with Commercially Out-of-Specification Axicabtagene Ciloleucel 製品規格外Axicabtagene Ciloleucelを用いた患者治療のための拡大アクセス試験(EAP) |
||
| A Phase 3, Open-Label Study to Evaluate Safety and Efficacy of Epcoritamab in Combination with Rituximab and Lenalidomide (R2) compared to R2 in Subjects with Relapsed or Refractory Follicular Lymphoma (EPCORE™ FL-1) 再発又は難治性の濾胞性リンパ腫被験者を対象として,エプコリタマブとリツキシマブ + レナリドミド(R2)療法を併用投与したときの安全性及び有効性をR2療法と比較評価する第III相非盲検試験(EPCORE™ FL 1) |
||
| Elranatamab(PF-06863135)の継続投与試験 | ||
| 呼吸器内科 | 特発性肺線維症患者を対象としたBMS-986278の有効性、安全性及び忍容性を検討する試験 | |
| 進行性肺線維症患者を対象とした BMS-986278の有効性、安全性及び忍容性を検討する試験 | ||
| 泌尿器科 | 筋層浸潤性膀胱癌に対するMK-3475(ペムブロリズマブ)の第Ⅱ相試験 | 医師主導治験 |
| 心臓血管外科 | 経食道運動誘発電位ならびに測定に用いる経食道脊髄刺激電極の有効性及び安全性を検討する第 Ⅲ相試験 | 医師主導治験 |
実施中の治験一覧
| 診療科 | 課題名 / 試験名 | 備考 |
|---|---|---|
| 循環器内科 | 心臓リハビリテーションの適応となる心疾患患者を対象としたRH-01の有効性及び安全性を検証する多施設共同無作為化並行群間比較試験 | 医師主導治験 |
| 慢性心不全患者に対するHUCV002-01静脈投与療法の有効性及び安全性を検討する多施設共同第IIb相医師主導治験(継続試験) | 医師主導治験 | |
| 慢性心不全患者に対するHUCV002-01静脈投与療法の有効性及び安全性を検討する多施設共同第IIb相医師主導治験 | 医師主導治験 | |
| Fontaine分類 IIb度の下肢閉塞性動脈硬化症の患者を対象にしたEIM-001の下肢筋肉内投与による二重盲検ランダム化比較試験 | 医師主導治験 | |
| 症候性閉塞性肥大型心筋症の成人患者を対象としたmavacamtenの第3相試験 | ||
| 心血管疾患を対象としたOlpasiran (AMG 890)の第III相試験 | ||
| 脳卒中リスクのある 18 歳以上の心房細動の患者を対象に、脳卒中又は全身性塞栓症の発症抑制に関する、経口FXIa阻害薬asundexian(BAY2433334)の有効性及び安全性をアピキサバンと比較する多施設共同、無作為化、実薬対照、二重盲検、ダブルダミー、二群間並行群間比較、第Ⅲ相国際共同試験 | ||
| 急性リンパ性白血病患者を対象としたブリナツモマブの第III相試験 | ||
| Fontaine分類Ⅲ及びⅣ度の下肢閉塞性動脈硬化症の患者を対象にしたEIM-001の下肢筋肉内投与による二重盲検ランダム化比較試験 | 医師主導治験 | |
| 脳神経内科 | 高用量E0302の筋萎縮性側索硬化症に対する第Ⅲ相試験-医師主導治験- | 医師主導治験 |
| 遅発型ポンペ病患者を対象としたCIPAGLUCOSIDASE ALFA及びミグルスタット併用投与の拡大治験 | ||
| 成人の慢性炎症性脱髄性多発根神経炎(CIDP)患者を対象としたNipocalimab の第Ⅱ/Ⅲ相試験 | ||
| EFFICACY AND SAFETY OF POZELIMAB AND CEMDISIRAN COMBINATION THERAPY IN PATIENTS WITH SYMPTOMATIC GENERALIZED MYASTHENIA GRAVIS 症候性全身型重症筋無力症患者を対象としたpozelimab及びcemdisiran併用療法の有効性及び安全性 |
||
| 呼吸器内科 | ステージ I/II 非小細胞肺癌の患者を対象としたデュルバルマブの第III相試験 | |
| 進行非扁平上皮非小細胞肺癌に対するカルボプラチン+ペメトレキセド+アテゾリズマブ療法とカルボプラチン+ペメトレキセド+アテゾリズマブ+ベバシズマブ療法の多施設共同オープンラベル無作為化第Ⅲ相試験 | 医師主導治験 | |
| 非小細胞肺癌患者を対象としたBMS-936558/BMS-734016の第Ⅲ相試験 | ||
| REGN2810の第1相試験 | ||
| 慢性閉塞性肺疾患(COPD)患者を対象としたベンラリズマブの第Ⅲ相試験 | ||
| 非小細胞肺癌患者を対象としたBMS-936558の第Ⅲ相試験 | ||
| 肺がん患者を対象としたAMG510の第Ⅲ相試験 | ||
| 局所進行非小細胞肺癌患者を対象としたBMS-936558/BMS-734016の第Ⅲ相試験 | ||
| ニボルマブの臨床試験に参加した患者さんを対象とした長期追跡第Ⅱ相試験 | ||
| 進行性非小細胞肺癌を有する被験者を対象として第3世代EGFR-TKI JNJ-73841937(Lazertinib)の単剤投与又はヒト二重特異性抗EGFR及びcMet抗体JNJ-61186372との併用投与における安全性及び薬物動態を評価する第1/1b相,非盲検試験 | ||
| EGFRエクソン20挿入変異を有する局所進行又は転移性非小細胞肺癌患者を対象としてamivantamabとカルボプラチン及びペメトレキセドの併用療法とカルボプラチン及びペメトレキセドを比較するランダム化,非盲検,第3相試験 | ||
| 未治療進展型小細胞肺癌に対するシスプラチン+イリノテカン+デュルバルマブ(MEDI4736)療法の多施設共同単群第II相試験 | 医師主導治験 | |
| 嚢胞性線維症を伴わない気管支拡張症患者を対象としたBrensocatibの第Ⅲ相試験 | ||
| TAS-115(pamufetinib)の第II相用量反応試験 | ||
| EGFR遺伝子変異陽性非小細胞肺がんを対象としたONO-7475の第Ⅰ相試験 | ||
| KRAS G12C変異陽性の化学療法未治療進行再発の非扁平上皮・非小細胞肺癌患者を対象としたsotorasib+カルボプラチン+ペメトレキセドの第II相試験 | 医師主導治験 | |
| オシメルチニブが無効となったEGFR変異局所進行又は転移性非小細胞肺癌患者を対象としてアミバンタマブ及びlazertinibとプラチナ製剤を含む化学療法の併用とプラチナ製剤を含む化学療法を比較する第3相、非盲検、ランダム化試験 | ||
| PD-L1発現で選定された、未治療の局所進行、切除不能、又は遠隔転移を伴う非小細胞肺癌患者を対象としたBGB A317-A1217-302(AdvanTIG-302)の第Ⅲ相試験 | ||
| 悪性腫瘍患者を対象としたマスタースクリーニング試験/局所進行切除不能Ⅲ期非小細胞肺癌患者を対象としたアレクチニブ,エヌトレクチニブ,Pralsetinibの第Ⅰ-Ⅲ相試験 | ||
| 非小細胞肺癌患者を対象としたSacituzumab Govitecanの第3相試験 | ||
| 特発性肺線維症患者を対象としたBI 1015550の第Ⅲ相試験 | ||
| 進行性線維化を伴う間質性肺疾患患者を対象としたBI 1015550の第Ⅲ相試験 | ||
| 特発性肺線維症患者を対象としたBMS-986278の有効性、安全性及び忍容性を検討する試験 | ||
| 進行性肺線維症患者を対象とした BMS-986278の有効性、安全性及び忍容性を検討する試験 | ||
| 血液内科 | 未治療のびまん性大細胞型B細胞リンパ腫患者を対象としたポラツズマブ ベドチンとR-CHP併用療法の有効性及び安全性をR-CHOP併用療法と比較する第III相試験 | |
| ハイリスクのくすぶり型多発性骨髄腫患者を対象にダラツムマブの皮下投与と積極的経過観察を比較検討する第3 相ランダム化多施設共同試験 | ||
| 造血幹細胞移植による初回治療が予定されていない未治療の多発性骨髄腫患者を対象にダラツムマブ,ボルテゾミブ,レナリドミド,及びデキサメタゾン併用(D-VRd)とボルテゾミブ,レナリドミド,及びデキサメタゾン併用(VRd)を比較する第3相試験 | ||
| 未治療マントル細胞リンパ腫患者に対するAcalabrutinibの第Ⅲ相試験 | ||
| 日本人の成熟B細胞性悪性腫瘍患者を対象としたzanubrutinibの第I/II相試験 | ||
| 骨髄異形成症候群患者を対象としたベネトクラクスの第Ⅲ相試験 | ||
| INCB050465(Parsaclisib)の第2相試験 A Phase 2 study of INCB050465 (Parsaclisib) at the request of Incyte Biosciences Japan G.K. | ||
| 造血幹細胞移植(HSCT)後に血栓性微小血管症(TMA)を呈する患者を対象としたラブリズマブの第Ⅲ相試験 | ||
| Therapy in Subjects with Relapsed/Refractory Myelofibrosis (TRANSFORM-2)再発/難治性骨髄線維症患者を対象にnavitoclaxとルキソリチニブの併用投与の有効性及び安全性を利用可能な最良の治療と比較評価する無作為化非盲検第Ⅲ相試験(TRANSFORM-2) | ||
| CTL019の第Ⅲb相試験 | ||
| びまん性大細胞型B細胞リンパ腫患者を対象とした第III相試験 | ||
| 骨髄線維症患者を対象としたINCB050465(Parsaclisib)の第Ⅲ相試験 | ||
| マントル細胞リンパ腫患者を対象としたLOXO-305の第3相試験 | ||
| A Phase 1 Study of JNJ-64007957, a Humanized BCMA x CD3 Bispecific Antibody in Japanese Patients with Relapsed or Refractory Multiple Myeloma 再発又は難治性多発性骨髄腫を有する日本人患者を対象としたヒト化BCMA×CD3二重特異性抗体JNJ-64007957の第1相試験 第Ⅰ相試験 |
||
| 製品規格に適合しないLISOCABTAGENE MARALEUCELを被験者に投与する拡大アクセス試験(EAP) | ||
| 未治療CD20陽性B細胞性濾胞性リンパ腫患者を対象としたIDEC-C2B8-SCの臨床第Ⅲ相試験 | ||
| 再発/難治性濾胞性リンパ腫患者及び辺縁帯リンパ腫患者を対象としたINCMOR00208の第3相試験 | ||
| 慢性移植片対宿主病を対象としたME3208の第III相試験 | ||
| B細胞性非ホジキンリンパ腫患者を対象としたREGN1979の第Ⅱ相試験 | ||
| 初発のフィラデルフィア染色体陽性の慢性期慢性骨髄性白血病患者を対象としたABL001の第Ⅲ相試験 | ||
| 再発又は難治性の多発性骨髄腫患者を対象としたヒト化GPRC5D×CD3二重特異性抗体talquetamabの第1/2相,first-in-human,非盲検,用量漸増試験 | ||
| 再発又は難治性(R/R)B 細胞性非ホジキンリンパ腫(B-NHL)を対象としたツシジノスタットとリツキシマブ併用の第 Ib/II 相試験 | ||
| 慢性特発性血小板減少性紫斑病を有する日本人成人患者を対象として血小板減少症の治療におけるavatrombopagの有効性及び安全性を評価する非盲検試験 | ||
| 多発性骨髄腫患者を対象としたベネトクラクスの第Ⅲ相試験 | ||
| 急性骨髄性白血病患者を対象としたMagrolimabの第Ⅲ相試験 | ||
| A Phase 3, Randomized, Open-Label Study to Evaluate Safety and Efficacy of Epcoritamab in Combination with R-CHOP Compared to R-CHOP in Subjects with Newly Diagnosed Diffuse Large B-Cell Lymphoma (DLBCL) 初発のびまん性大細胞型B 細胞リンパ腫(DLBCL)患者を対象とした,エプコリタマブとR-CHOP の併用療法の安全性及び有効性をR-CHOP 療法と比較する第III 相,無作為化,非盲検試験 |
||
| 温式自己免疫性溶血性貧血を対象としたVAY736の第Ⅲ相試験 | ||
| パルサクリシブ (INCB050465)を継続投与する第Ⅱ相試験 | ||
| 再発又は難治性のびまん性大細胞型 B 細胞リンパ腫を対象としたMT-2111の第Ⅲ相試験 | ||
| 同種造血細胞移植(同種HCT)を受ける急性骨髄性白血病(AML)患者に対する補助療法及び維持療法としてのMocravimodの有効性及び安全性を評価するための前向き、ランダム化、二重盲検、プラセボ対照、多施設共同第III 相試験 | ||
| Expanded Access Study for the Treatment of Patients with Commercially Out-of-Specification Axicabtagene Ciloleucel 製品規格外Axicabtagene Ciloleucelを用いた患者治療のための拡大アクセス試験(EAP) |
||
| A Phase 3, Open-Label Study to Evaluate Safety and Efficacy of Epcoritamab in Combination with Rituximab and Lenalidomide (R2) compared to R2 in Subjects with Relapsed or Refractory Follicular Lymphoma (EPCORE™ FL-1) 再発又は難治性の濾胞性リンパ腫被験者を対象として,エプコリタマブとリツキシマブ + レナリドミド(R2)療法を併用投与したときの安全性及び有効性をR2療法と比較評価する第III相非盲検試験(EPCORE™ FL 1) |
||
| Elranatamab(PF-06863135)の継続投与試験 | ||
| 腫瘍内科 | 食道がん患者を対象としたニボルマブとイピリムマブの第Ⅲ相試験 | |
| 胃腺癌及び食道胃接合部腺癌を対象としたMK-3475の第Ⅲ相試験 | ||
| 胃癌を対象としたMK-3475の第Ⅲ相試験 | ||
| 胆道癌患者を対象としたMK-3475の第Ⅲ相試験 | ||
| 結腸・直腸癌患者を対象としたMK-7902/E7080(レンバチニブ) とMK-3475(ペムブロリズマブ)の第Ⅲ相試験 | ||
| 胃癌を対象としたDS-8201a(trastuzumabderuxtecan)の第Ⅲ相試験 | ||
| 胃癌又は食道胃接合部癌患者を対象としたAMG 552第III相試験 | ||
| MK-3475の治験に参加した進行悪性腫瘍患者を対象とした第Ⅲ相継続試験 | ||
| 胃癌又は食道胃接合部癌患者を対象としたAMG 552の第Ib/III相試験 | ||
| HER2陽性の胃腺癌又は胃食道接合部腺癌患者を対象としたTrastuzumab Deruxtecan術前化学療法の第II相臨床試験 | 医師主導治験 | |
| An Open-label Randomized Phase 3 Study of Tucatinib in Combination with Trastuzumab and mFOLFOX6 versus mFOLFOX6 given with or without either Cetuximab or Bevacizumab as First-line Treatment for Subjects with HER2+ Metastatic Colorectal Cancer HER2陽性転移性結腸直腸癌被験者を対象に、一次治療としてのトラスツズマブ及びmFOLFOX6併用tucatinibをセツキシマブ若しくはベバシズマブ併用又は非併用mFOLFOX6と比較する非盲検、無作為化、第3相試験 |
||
| 未治療のdMMR/MSI-H を有する切除可能な結腸癌患者を対象としたdostarlimab の第III 相試験 | ||
| HER2陽性転移性胃食道腺癌患者を対象としたZanidatamabとの化学療法併用の第Ⅲ相試験 | ||
| 胃がんを対象としたONO-4578の第Ⅱ相試験 | ||
| 膠原病・リウマチ内科 | 全身性エリテマトーデス患者を対象としたBIIB059の第Ⅲ相試験 | |
| 好酸球性多発血管炎性肉芽腫症における神経障害に対するGB-0998の有効性、安全性を検討する多施設共同オープン試験 | ||
| 精神・神経科 | アルツハイマー病患者を対象としたBIIB037の第Ⅲb相試験 | |
| 早期症候性アルツハイマー病を対象としたLY3002813の第Ⅲ相試験 | ||
| 早期症候性アルツハイマー病を対象としたLY3372689の第Ⅱ相試験 | ||
| LY3372993の第Ⅲ相試験 | ||
| 小児科 | 好酸球性重症喘息患者を対象としたGSK3511294をメポリズマブ又はベンラリズマブと比較評価する非劣性試験 | |
| 乳腺外科 | Phase III Study of Trastuzumab Deruxtecan (T-DXd) with or without Pertuzumab versus Taxane, Trastuzumab and Pertuzumab in HER2-positive, First-line Metastatic Breast Cancer (DESTINY-Breast09) HER2陽性の転移性乳癌に対する一次治療としてトラスツズマブ デルクステカン(T-DXd)の単剤投与またはT-DXdとペルツズマブの併用投与と、タキサン、トラスツズマブ、及びペルツズマブの併用療法を比較検討する第III相試験(DESTINY-Breast09試験) |
|
| 脳神経外科 | 慢性期脳梗塞(脳梗塞発症後150日以降365日以内)患者に対するMB-001(CD34陽性細胞分離機器)を用いた自家末梢血CD34陽性細胞の内頚動脈内投与に関する医師主導治験 |
医師主導治験 医療機器 |
| G-009を用いた頭蓋内脳動脈瘤塞栓術の安全性及び有効性を評価する多施設共同単一群検証的試験 | ||
| 急性期虚血性脳卒中又は高リスク一過性脳虚血発作後の脳卒中の再発抑制を目的とした経口第XIa因子阻害剤Milvexianの有効性及び安全性を評価する第3相,ランダム化,二重盲検,並行群間,プラセボ対照試験 | ||
| 泌尿器科 | 根治的前立腺全摘除術の候補である高リスクかつ限局性又は局所進行性前立腺癌を対象としたapalutamideの第Ⅲ相試験 | |
| 去勢抵抗性前立腺癌を対象としたMK-7339の第Ⅲ相試験 | ||
| 転移性ホルモン感受性前立腺癌を対象としたAZD5363の第Ⅲ相試験 | ||
| 転移性去勢抵抗性前立腺癌患者を対象としたLY2835219の第Ⅱ/Ⅲ相試験 | ||
| 前立腺がんを対象としたAAA617の第Ⅲ相試験 | ||
| AAA617の第Ⅱ相試験 | ||
| ハイリスクの転移性ホルモン感受性前立腺癌男性患者を対象としたLY2835219の第Ⅲ相試験 | ||
| 前立腺がんを対象としたAZD5363の第Ⅲ相試験 | ||
| 腎細胞癌患者を対象としたMK-6482の第Ⅲ相試験 | ||
| カルメット・ゲラン桿菌(BCG)未治療の高リスク筋層非浸潤 性 膀胱癌(HR-NMIBC)患者を対象に,TAR-200 と cetrelimab の併用投与又は TAR-200 単独投与と,BCG 膀胱内投与の有効性及び安全性を比較する,第 3 相非盲検多施設共同ランダム化試験 | ||
| 筋層浸潤性膀胱癌に対するMK-3475(ペムブロリズマブ)の第Ⅱ相試験 | 医師主導治験 | |
| 放射線診断科 | Efficacy and safety of gadopiclenol for Magnetic Resonance Imaging (MRI) in Japanese adults and children Phase III Clinical Trial 日本人成人及び小児を対象とした磁気共鳴画像法(MRI)におけるgadopiclenolの有効性及び安全性を評価する第III相試験 |
|
| 産婦人科 | 進行卵巣癌を対象としたオラパリブ/デュルバルマブの第Ⅲ相試験 | |
| 子宮内膜異型増殖症・子宮体癌に対するメドロキシプロゲステロンとメトホルミンの併用妊孕性温存療法の用量反応性試験 | 医師主導治験 | |
| 心臓血管外科 | 生体弁置換術後の抗凝固療法における直接経口抗凝固薬エドキサバンの 有効性および安全性に関する多施設共同無作為化比較試験 | 医師主導治験 |
| 経食道運動誘発電位ならびに測定に用いる経食道脊髄刺激電極の有効性及び安全性を検討する第 Ⅲ相試験 | 医師主導治験 |
臨床研究に関する公開情報
当院では、診療情報(診療で得られたデータ)等だけを用いて研究を行うことがありますが、その場合は、国が定めた倫理指針に基づき、オプトアウトの手続きを取っています。
オプトアウトとは、患者さんへ研究内容を説明し同意を頂く代わりに、情報(研究の概要)を通知又は公開し、研究が実施又は継続されることについて患者さんが拒否できる機会を保障する手法のことを言います。
以下、研究毎に情報を公開しています。
当院でオプトアウトを行っている臨床研究
| 管理用番号 | 研究課題名 | 診療科 | 当院責任者 | 初回承認日 | 情報公開文書 |
|---|---|---|---|---|---|
| 研24018 | 閉鎖孔ヘルニアの病態及び治療法と予後についての全国調査研究 | 外科 | 成田 匡大 | 2024/4/11 | |
| 研24016 | 腫瘍関連肺高血圧症レジストリ研究 (Japan Tumoral Pulmonary Hypertension Registry) |
循環器内科 | 古川 裕 | 2024/4/12 | |
| 研24013 | 切除可能膵癌に対する至適な術前胆道ドレナージに関する検討 | 消化器内科 | 秋山 慎介 | 2024/3/29 | |
| 研24012 | 切除不能進行胆道癌に対するGCD療法の安全性と有効性に関する検討 | 消化器内科 | 秋山 慎介 | 2024/3/29 | |
| 研24011 | アゾール系抗真菌薬および分子標的薬のPK/PD評価 | 血液内科 | 近藤 忠一 | 2024/3/29 | |
| 研24010 | 当院における胆嚢癌・胆嚢癌疑診例における術前診断の精度と問題点 | 外科 | 鳥口 寛 | 2024/3/29 | |
| 研24009 | ドクターカーの運用事例に関する調査研究 | 救急科 | 松岡 由典 | 2024/3/28 | |
| 研24006 | 筋層浸潤性膀胱癌に対するdose-dense GCによる術前化学療法の有効性と安全性についての検討 | 泌尿器科 | 山﨑 俊成 | 2024/3/18 | |
| 研24005 |
フレイルを有する高齢心不全患者の退院後リハビリテーションの有無と予後の関連 | リハビリテーション技術部 | 岩田 健太郎 | 2024/3/18 | |
| 研24004 | 多機関脳動脈瘤患者コホートを使用したAIに基づく脳動脈瘤診断、増大予測システムの検証研究 | 脳神経外科 | 太田 剛史 | 2024/3/12 | |
| 研24003 | COVID19パンデミック後の呼吸器感染症変動期における川崎病患者のFilm Array®による呼吸器感染ウイルス検出動向 | 小児科 | 濱畑 啓悟 | 2024/3/11 | |
| 研24002 | 地方政令指定都市のK病院における外科医不足の実態と今後の課題 | 外科 | 小林 裕之 | 2024/3/11 | |
| 研24001 | 偶発胆嚢癌に対する多機関共同後ろ向きコホート研究 | 外科 | 成田 匡大 | 2024/3/12 | |
| 研23246 | 心臓植え込み型デバイス移植後の三尖弁閉鎖不全症の発症と予後に関する後ろ向き研究 | 循環器内科 | 金 基泰 | 2024/3/11 | |
| 研23243 | BRCA遺伝学的検査に関するデータベースの作成 | 産婦人科 | 林 信孝 | 2024/3/1 | |
| 研23242 | 免疫チェックポイント阻害薬による有害事象早期発見のための薬剤師による検査入力支援の有用性に関する研究 | 薬剤部 | 室井 延之 | 2024/3/1 | |
| 研23239 | 緊急再開通治療でステント留置を要する症例におけるtPAの安全性について | 脳神経外科 | 寺西 邦匡 | 2024/2/29 | |
| 研23238 | 実臨床におけるBRAF変異陽性切除不能大腸がんに対する観察研究 | 腫瘍内科 | 安井 久晃 | 2024/2/29 | |
| 研23237 | 経カテーテル大動脈弁植え込み患者におけるABI/baPWV検査指標と心血管イベントの関連 | 臨床検査技術部 | 林 風侑花 | 2024/2/29 | |
| 研23236 | がん診療に関する院内リアルワールドデータ(RWD)の網羅的収集および利活用に関する多施設共同研究(CONNECT-2) | 腫瘍内科 | 安井 久晃 | 2024/2/29 | |
| 研23235 | BRCA病的バリアントを有する乳癌患者におけるCDK4/6阻害剤使用例の検討:後ろ向きコホート研究 | 乳腺外科 | 大段 仁奈 | 2024/2/29 | |
| 研23234 | レセプトデータを用いた患者状態判定のためのアルゴリズム開発 | 血液内科 | 下村 良充 | 2024/2/29 | |
| 研23233 | 硬膜動静脈瘻に対するOnyx TAEの治療成績に関する検討 | 脳神経外科 | 武田 純一 | 2024/2/29 | |
| 研23232 | 退院時のステロイド投与量による感染症の発症及び再入院に関する研究 | 腎臓内科 | 大﨑 啓介 | 2024/2/29 | |
| 研23231 | 時定数2秒での脳波記録(infraslow activity)を使用したTFNE(transient focal neurological episode)病態解明 | 脳神経内科 | 川本 未知 | 2024/2/29 | |
| 研23230 |
びまん性特発性骨増殖症(DISH)の脊椎骨折の麻痺、治療成績に関する後ろ向き研究 | 整形外科 | 大西 英次郎 | 2024/2/29 | |
| 研23229 | 新型コロナウイルス感染蔓延期の川崎病患者の再上昇:―神戸市人口基盤2021-2023年調査― | 小児科 | 濱畑 啓悟 | 2024/2/22 | |
| 研23228 | FilmArray髄膜炎・脳炎パネルが有用であったヒトパレコウイルス中枢神経感染症の集積 | 小児科 | 濱畑 啓悟 | 2024/2/22 | |
| 研23227 | 頭頸部がん患者における同時化学放射線療法による口腔咽頭粘膜炎に対するオピオイド鎮痛薬の適正使用を目指した使用状況調査と疼痛マネジメントの検討 | 薬剤部 | 室井 延之 | 2024/2/27 | |
| 研23226 | 緊急腹部手術を受けた重症患者における周術期乳酸クリアランスによる予後予測の検討 | 麻酔科 | 西川 貴史 | 2024/2/20 | |
| 研23224 | 胃癌conversion surgeryにおける低侵襲手術の意義 | 外科 | 松田 正太郎 | 2024/2/21 | |
| 研23223 | 無抗凝固での持続的腎代替療法における早期回路閉塞の予測因子 | 麻酔科 | 伊藤 次郎 | 2024/2/16 | |
| 研23221 | エンフォルツマブベドチンによる皮膚障害の発症様式に関する多機関共同観察研究 | 泌尿器科 | 山﨑 俊成 | 2024/2/15 | |
| 研23220 | 重症COVID-19 患者における集中治療後症候群の回復過程に関する調査 | リハビリテーション技術部 | 岩田 健太郎 | 2024/2/16 | |
| 研23219 | 機械的脳血栓除去術を受けた患者における虚血コア容積と神経学的転帰不良との間の時間変化の関係 | 脳神経内科 | 前川 嵩太 | 2024/2/13 | |
| 研23216 | COVID-19流行後に呼吸器疾患増悪で救急外来を受診した成人患者の多項目PCR検査による罹患ウイルスと臨床像の調査 | 呼吸器内科 | 笹田 剛史 | 2024/2/13 | |
| 研23214 | 肺動脈カテーテルによる重篤な合併症を生じた11例の検討 | 麻酔科 | 吉田 晴香 | 2024/2/6 | |
| 研23213 | 胃底腺型胃癌におけるリンパ節転移の危険因子に関する多機関共同後ろ向き研究 | 消化器内科 | 籔内 洋平 | 2024/2/6 | |
| 研23211 | 急性下部消化管出血患者のクリニカルアウトカムの実態とその関連因子の解明:多施設共同後ろ向き研究 | 消化器内科 | 籔内 洋平 | 2024/2/7 | |
| 研23209 | クモ膜下出血後の髄膜炎と脳血管攣縮の関係性について | 脳神経外科 | 寺西 邦匡 | 2024/2/2 | |
| 研23204 | 新規自動血球分析システムの分析性能の検証研究 | 血液内科 | 石川 隆之 | 2024/1/31 | |
| 研23203 | 血栓性血小板減少性紫斑 病(TTP)に生じる心筋虚血と好中球細胞外トラップ(NETs)の評価 |
血液内科 | 平本 展大 | 2024/2/6 | |
| 研23202 | 当施設におけるロボット支援下結腸切除術での体腔内吻合の工夫と短期成績 | 外科 | 小山 達也 | 2024/1/30 | |
| 研23201 | デタッチャブルコイルのカテーテル内での意図的早期離脱と生理食塩水フラッシュによる留置法の有用性と安全性の検討 | 放射線診断科 | 安藤 久美子 | 2024/1/30 | |
| 研23199 | リウマチ性疾患の早期診断、病態解明、治療指針確立のための観察研究 | 整形外科 | 齋藤 遼平 | 2024/1/30 | |
| 研23195 | 未破裂脳動脈瘤に対する血管内治療における抗血小板剤の管理 | 脳神経外科 | 後藤 正憲 | 2024/1/19 | |
| 研23192 | 当院における間質性肺炎合併肺癌の治療成績 | 呼吸器外科 | 柏分 秀直 | 2024/1/17 | |
| 研23190 | 放射線治療における新しいマークシールの運用と検討 | 放射線技術部 | 福井 達也 | 2024/1/5 | |
| 研23189 | 心エコーデータを用いた循環器病患者の心機能・予後評価に関する検討 | 循環器内科 | 佐野 円香 | 2024/1/11 | |
| 研23187 | 骨軟部組織感染症の治療に関する多施設共同研究 | 整形外科 | 山下 伸之輔 | 2023/12/28 | |
| 研23186 | SLEの治療最適化を目指した多施設研究 | 膠原病・リウマチ内科 | 大村 浩一郎 | 2024/1/5 | |
| 研23185 | 切除不能局所進行膵癌に対するConversion Surgeryの 新規化学療法導入後治療成績の再検討 | 外科 | 貝原 聡 | 2024/2/21 | |
| 研23184 | 当院におけるロボット支援下尾側膵切除:導入から現在までの工夫と変遷 | 外科 | 鳥口 寛 | 2023/12/27 | |
| 研23180 | 本邦におけるPOEMS 症候群自家移植症例の長期予後の解析 | 血液内科 | 平本 展大 | 2023/12/25 | |
| 研23178 | u-HA/PLLAを用いた上顎骨形成術の術後安定性に対する3次元的評価 | 歯科口腔外科 | 山本 信祐 | 2023/12/25 | |
| 研23177 | 喉頭希少疾患における疫学、経過、治療成績、および予後の検証 | 頭頸部外科 | 篠原 尚吾 | 2023/12/20 | |
| 研23173 | 限局型小細胞肺癌に対する化学放射線療法後再発症例におけるプラチナ製剤+エトポシド+PD-L1阻害薬の効果および安全性についての後ろ向き研究 | 呼吸器内科 | 佐藤 悠城 | 2023/12/12 | |
| 研23172 | 京都大学医学部附属病院にてエキスパートパネルを受けた症例を対象とした多施設共同後ろ向き観察研究 | 腫瘍内科 | 安井 久晃 | 2023/12/20 | |
| 研23170 | 化膿性脊椎炎における起因菌同定と治療成績に関与する因子の検討 | 整形外科 | 大西 英次郎 | 2023/12/14 | |
| 研23169 | 肺MALTリンパ腫の初診時および治療前病態、治療選択と予後に関する多機関共同調査研究(PALM-T study) | 放射線治療科 | 小久保 雅樹 | 2023/12/12 | |
| 研23168 | 成人スティル病におけるサイトカインと免疫細胞が臨床経過に与える影響と、再燃時の新規バイオマーカーの探索 | 膠原病・リウマチ内科 | 大村 浩一郎 | 2023/12/12 | |
| 研23166 | 当院における80歳以上の高齢者に対する肝細胞癌の外科治療の現状と問題点 | 外科 | 鳥口 寛 | 2023/12/12 | |
| 研23165 | eCura Systemの外的妥当性に関する多機関共同後ろ向き観察研究 | 消化器内科 | 籔内 洋平 | 2023/12/8 | |
| 研23164 | COVID-19が手術室運営に与えた影響 | 麻酔科 | 宮脇 郁子 | 2023/12/1 | |
| 研23162 | 高齢心臓血管外科手術患者における入院関連機能低下(Hospital Acquired Functional Decline : HAFD) ~術前情報から診た予測精度と予測モデル~ | リハビリテーション技術部 | 岩田 健太郎 | 2023/11/28 | |
| 研23161 | COVID-19流行下における集中治療室の医療ひっ迫と臨床転帰との関連についての検討 | 麻酔科 | 嶋田 博樹 | 2023/11/29 | |
| 研23160 | 脾動脈解離に関する研究 | 放射線診断科 | 光野 重芝 | 2023/11/24 | |
| 研23159 | 体外式膜型人工肺(ECMO)を用いて全肺洗浄(WLL)を行った肺胞蛋白症(PAP)患者3例について | 呼吸器内科 | 中川 淳 | 2023/11/27 | |
| 研23158 | 日本の急性期総合病院を対象とした下気道感染症のデータベース構築と再発性下気道感染症に対する抗緑膿菌活性をもつ抗菌薬の経験的使用の有効性の検討 | 呼吸器内科 | 富井 啓介 | 2023/11/21 | |
| 研23157 | 小児におけるB群連鎖球菌感染症ナショナルサーベイランス | 小児科・新生児科 | 濱畑 啓悟 | 2023/11/21 | |
| 研23155 | 左室駆出率保持型心不全の正確な診断アルゴリズムの確立に向けた多施設共同研究 | 循環器内科 | 岡田 大司 | 2023/11/20 | |
| 研23154 | 婦人科悪性腫瘍におけるがん遺伝子パネル検査の現状に関する多機関共同観察研究 | 産婦人科 | 青木 卓哉 | 2023/11/15 | |
| 研23153 | 胃腫瘍に対するゲル浸漬下内視鏡的粘膜切除術の治療成績に関する多施設後ろ向き研究 | 消化器内科 | 籔内 洋平 | 2023/11/14 | |
| 研23152 | ドパミントランスポーターシンチグラフィ検査における解剖学的標準化が定量解析に与える影響の検討 | 放射線技術部 | 小山 寛之 | 2023/11/20 | |
| 研23150 | 固形癌における免疫応答解析に基づくがん免疫療法の効果予測診断法確立に関する多施設共同研究 | 呼吸器内科 | 富井 啓介 | 2023/11/20 | |
| 研23148 | 下部消化管穿孔を発症した重症患者における微生物学的研究および患者予後の検討 | 麻酔科 | 西川 貴史 | 2023/11/14 | |
| 研23147 | 甲状腺癌に対する糖尿病治療の影響について | 糖尿病内分泌内科 | 籏谷 雄二 | 2023/11/14 | |
| 研23145 | がん対策進捗管理のための患者体験調査 | 情報企画課 | 小前 哲治 | 2023/11/13 | |
| 研23143 | 一般社団法人日本脳神経外科学会データベース研究事業(Japan Neurosurgical Database:JND) | 脳神経外科 | 太田 剛史 | 2023/11/7 | |
| 研23142 | 僧帽弁形成術後の長期予後調査 | 循環器内科 | 佐野 円香 | 2023/11/2 | |
| 研23141 | 発作性交感神経過活動(PSH)と特発性脳内出血の院内死亡との関連についての検討:後向きコホート研究 | 脳神経内科 | 太田 和馬 | 2023/10/26 | |
| 研23140 | Real-world data (RWD) による抗がん剤の費用対効果研究進展型小細胞肺癌における免疫療法(Atezolizumab vs. Durvalumab)の比較検討 | 呼吸器内科 | 佐藤 悠城 | 2023/10/26 | |
| 研23138 | 超音波内視鏡下吸引穿刺法によって生じた出血に対する血管塞栓術の有効性、安全性の検討 | 放射線診断科 | 安藤 久美子 | 2023/10/24 | |
| 研23136 | CPA発生前の生体情報の変化とCPA発生との関連の後ろ向き観察研究 | 臨床工学技術部 | 坂地 一朗 | 2023/10/18 | |
| 研23135 | 京都大学外科関連施設における大腸癌手術治療成績の検討 | 外科 | 橋田 裕毅 | 2023/10/19 | |
| 研23134 | 脛骨骨幹部骨折に対する髄内釘固定による日本の標準的治療: 多機関共同後ろ向きコホート研究 | 整形外科 | 山下 伸之輔 | 2023/10/30 | |
| 研23133 | 循環器疾患診療実態調査(JROAD)のデータベースとCRT患者の予後に関わる因子に関する研究 | 循環器内科 | 江原 夏彦 | 2023/10/19 | |
| 研23131 | 悪性腫瘍に随伴する急性期主幹動脈閉塞の診断方法について | 脳神経外科 | 﨑須賀 涼 | 2023/10/18 | |
| 研23130 | 進行性尿路上皮癌に対するエンホリツマブ/ベドチンの治療成績 Clinical Outcome of Enfortumab Vedotin for Advanced Urothelial Carcinoma |
泌尿器科 | 山﨑 俊成 | 2023/10/4 | |
| 研23129 | 当院での生体腎移植のエベロリムス導入時期による成績の検討 | 泌尿器科 | 山﨑 俊成 | 2023/10/4 | |
| 研23128 | 投与中止に至る重篤な肺合併症の回避を目的としたクラゾセンタンの使用方法 | 脳神経外科 | 西井 陸大 | 2023/10/11 | |
| 研23127 | 骨軟部腫瘍における治療標的・予後因子の解明 | 病理診断科 | 原 重雄 | 2023/10/11 | |
| 研23126 | ループス腎炎治療におけるグルココルチコイド減量スピードによる腎予後の解析 | 膠原病・リウマチ内科 | 大村 浩一郎 | 2023/10/4 | |
| 研23125 | 膠原病・リウマチ性疾患の寛解導入時における、サイトメガロウイルスの再活性化から臓器障害を引き起こすリスク因子の検討 | 膠原病・リウマチ内科 | 大村 浩一郎 | 2023/10/3 | |
| 研23124 | 高齢者におけるde-escalation therapyと予後の検討:後視的コホート研究 | 乳腺外科 | 池田 真子 | 2023/10/3 | |
| 研23123 | マムシ咬傷の実態調査、およびウマ抗毒素血清の有用性とその安全な投与方法についての検討 | 救急科 | 松岡 由典 | 2023/9/26 | |
| 研23122 | 腎機能障害患者におけるボリコナゾール注長期投与の腎機能に対する影響について | 薬剤部 | 室井 延之 | 2023/10/2 | |
| 研23120 | 先天性難聴や高齢手術が人工内耳刺激条件に与える影響の調査 | 耳鼻咽喉科 | 山本 典生 | 2023/9/26 | |
| 研23117 | 当院における切除可能大腸癌肝転移に対する治療成績の現状と課題 | 外科 | 鳥口 寛 | 2023/9/26 | |
| 研23116 | 精神科リエゾンチームにおける薬剤師介入事例からの適正使用についての取り組み | 薬剤部 | 室井 延之 | 2023/9/26 | |
| 研23115 | 急性大動脈解離に伴う脳灌流障害における CT perfusion imaging | 心臓血管外科 | 中根 武一郎 | 2023/9/26 | |
| 研23113 | 構造的心疾患、大動脈疾患における診療、治療情報データベース | 循環器内科 | 谷口 智彦 | 2023/9/13 | |
| 研23110 | 過敏性肺炎の全国疫学調査 | 呼吸器内科 | 富井 啓介 | 2023/9/4 | |
| 研23106 | 閉塞血管の断端性状が機械的血栓回収療法の治療成績へ及ぼす影響の検討 | 脳神経内科 | 前川 嵩太 | 2023/8/30 | |
| 研23104 | Transdural blood supplyを有する脳動静脈奇形の臨床症状、血管構築、治療成績の検討:多施設共同研究 | 脳神経外科 | 太田 剛史 | 2023/9/4 | |
| 研23103 | EGFR遺伝子L858R変異陽性進行再発非扁平上皮非小細胞肺癌に対するRamucirumab + Erlotinibの有効性及び安全性を評価する多機関共同・後方視的観察研究(REAL-SPEED) | 呼吸器内科 | 佐藤 悠城 | 2023/8/25 | |
| 研23102 | 頭蓋内動脈の蛇行紡錘形動脈瘤(dolichoectasia)の病態形成及びその臨床像に関する研究 | 脳血管治療研究部 | 坂井 信幸 | 2023/8/25 | |
| 研23101 | 再発難治性急性リンパ性白血病における治療予測のための腫瘍免疫プロファイリングの開発 | 血液内科 | 近藤 忠一 | 2023/8/25 | |
| 研23098 | 177Lu- oxodotreotideと111In-PentetreotideのSPECT検査における集積度合の違いに関する技術的検討 | 放射線技術部 | 大政 亘 | 2023/8/18 | |
| 研23097 | 内視鏡下脳内血腫除去術の血腫除去率に関連する因子の検討 | 脳神経外科 | 太田 剛史 | 2023/8/17 | |
| 研23093 | 甲状腺乳頭癌患者T1-3N1bM0における放射性ヨード治療の効果に関する多施設共同研究 | 頭頸部外科 | 篠原 尚吾 | 2023/8/10 | |
| 研23092 | 病理組織検体を活用した造血器腫瘍の臨床病理学的研究 | 病理診断科 | 山下 大祐 | 2023/8/10 | |
| 研23091 | Alectinib、Brigatinib治療後の脳転移にLorlatinibが奏効したALK陽性肺癌の⼀例 | 呼吸器内科 | 佐藤 悠城 | 2023/8/9 | |
| 研23090 | 細胆管細胞癌の臨床病理学的特徴とその臨床的意義 | 外科 | 貝原 聡 | 2023/9/4 | |
| 研23089 | REALITY-AHF studyとAKINESIS studyのデータベース統合解析による日本と欧米の比較研究 | 循環器内科 | 古川 裕 | 2023/8/10 | |
| 研23088 | ステロイドパルス療法で治療導入を行った特発性肺線維症の急性増悪患者に対する初期治療反応性と予後の関連性についての後ろ向き観察研究 | 呼吸器内科 | 永田 一真 | 2023/8/8 | |
| 研23087 | 食道 ESD/EMR における偶発症に関する全国調査 | 消化器内科 | 森田 周子 | 2023/8/7 | |
| 研23086 | 入院時低栄養が機械的脳血栓回収療法の機能予後へ与える影響 | 脳神経内科 | 前川 嵩太 | 2023/8/7 | |
| 研23085 | 非アルコール性脂肪肝炎(NASH)肝硬変に対する肝移植後の再発、予後の検討 | 外科・移植外科 | 貝原 聡 | 2023/8/10 | |
| 研23084 | 未破裂内頚動脈終末部瘤の血管内治療の再治療に関する危険因子の検討 | 脳神経外科 | 山元 康弘 | 2023/8/7 | |
| 研23083 | 血液疾患患者における新型コロナウイルス中和抗体薬の臨床データおよび治療経過に関する疫学観察研究 | 血液内科 | 近藤 忠一 | 2023/7/28 | |
| 研23082 | 卵巣がん患者におけるPARP阻害薬の有害事象のリスク因子探索と血中濃度解析 | 薬剤部 | 室井 延之 | 2023/7/28 | |
| 研23081 | AJM300治験(CT3試験)保存血清を利用したバイオマーカーの測定、自覚症状改善時期及び寛解維持治療薬調査~ASPECT study~ | 消化器内科 | 井上 聡子 | 2023/7/24 | |
| 研23080 | 集中治療室へ入室した患者の要介護・要支援・CFSと予後の関連について | 救命救急センター・救急部 | 白川 和宏 | 2023/7/26 | |
| 研23071 | トラフェルミンを用いた鼓膜穿孔閉鎖術の有用性の検証 | 耳鼻咽喉科 | 山本 典生 | 2023/7/12 | |
| 研23069 | 集中治療医を多く配置する自治体病院集中治療室における収益性と患者の特徴の関係性 | 救急科 | 瀬尾 龍太郎 | 2023/7/6 | |
| 研23068 | 当院における高難度の腹腔鏡下肝切除術は患者に対して有益か | 外科 | 鳥口 寛 | 2023/7/6 | |
| 研23067 | 筋層浸潤性尿路上皮がん患者を対象としたニボルマブ術後補助療法の日本における治療実態研究(ANNIVERSARY 試験) | 泌尿器科 | 山﨑 俊成 | 2023/7/6 | |
| 研23063 | 有機リン中毒におけるプラリドキシム投与開始までの時間とコリンエステラーゼ値回復への影響に関する調査 | 薬剤部 | 室井 延之 | 2023/6/29 | |
| 研23059 | 院外心肺停止患者の原因と蘇生経過との関連性 | 救急科 | 有吉 孝一 | 2023/6/16 | |
| 研23051 | 動脈硬化性病変による急性主幹動脈閉塞に対する治療戦略 | 脳神経外科 | 高野 裕樹 | 2023/6/13 | |
| 研23047 | 神経内分泌腫瘍における177Lu-DOTATATEの集積と治療効果の検討 | 糖尿病・内分泌内科 | 藤本 寛太 | 2023/7/10 | |
| 研23040 | 糖尿病患者におけるトルソー症候群に対するリバーロキサバンの投与実態の調査 | 薬剤部 | 室井 延之 | 2023/6/6 | |
| 研23037 | 傍腫瘍性神経症候群を伴う肺小細胞癌の後ろ向き観察研究 | 呼吸器内科 | 佐藤 悠城 | 2023/6/5 | |
| 研23033 | 悪液質合併消化器がんに対するアナモレリンの有用性を探索する後方視的観察研究 | 腫瘍内科 | 安井 久晃 | 2023/5/23 | |
| 研23032 | 手術を行った副咽頭間隙腫瘍21例の検討 | 耳鼻咽喉科・頭頸部外科 | 道田 哲彦 | 2023/5/25 | |
| 研23030 | FES-PETによる乳癌のエストロゲン受容体の非侵襲的評価:後方視的研究 | 分子イメージング研究部 | 山根 登茂彦 | 2023/5/25 | |
| 研23028 | JAK阻害薬の周術期使用の安全性に関する観察研究 | 膠原病・リウマチ内科 | 大村 浩一郎 | 2023/5/23 | |
| 研23024 | 「エンハーツ点滴静注用100mg特定使用成績調査(乳癌)」患者を登録対象としたトラスツズマブ デルクステカン中止後の後治療に関するコホート研究 | 乳腺外科 | 武部 沙也香 | 2023/5/17 | |
| 研23015 | 経胸壁心エコー検査の右室心拍出量と右室収縮能指標における関連性の検討 | 臨床検査技術部 | 濱野 葵 | 2023/4/27 | |
| 研23009 | 難聴が疑われて精密検査機関・二次聴力検査機関を受診した0歳-6歳児についての社会的調査 | 耳鼻咽喉科 | 山本 典生 | 2023/4/26 | |
| 研23008 | 救命救急医が行うAdvance Care Planning (ACP)に関する研究 ~Study of Advance Care Planning by Acute Care Physician (ACP-2 study)~ |
救急部 | 白川 和宏 | 2023/4/26 | |
| 研23007 | 食道癌手術後の骨格筋量の低下に関連する因子の検討 | リハビリテーション技術部 | 岩田 健太郎 | 2023/4/19 | |
| 研23006 | 成人T細胞白血病(ATL) に対する同種移植後の予後に移植前モガムリズマブ投与が与える影響に関する研究 | 血液内科 | 近藤 忠一 | 2023/4/19 | |
| 研23005 | 生殖細胞系列遺伝子変異を有する造血器疾患患者における二次調査研究 | 血液内科 | 平本 展大 | 2023/4/17 | |
| 研23002 | 気管支喘息増悪入院の疫学調査及び罹患ウィルス毎の臨床像調査 | 小児科 | 岡藤 郁夫 | 2023/4/17 | |
| 研23001 | 骨髄異形成症候群に対する移植後大量シクロホスファミドを用いたHLA半合致同種末梢血幹細胞移植とHLA一致非血縁者間移植の移植後成績の比較検討 | 血液内科 | 下村 良充 | 2023/4/19 | |
| 研22249 | 僧帽弁位人工弁周囲逆流に対する外科的修復術の遠隔成績 | 心臓血管外科 | 吉田 一史 | 2023/4/5 | |
| 研22247 | 僧帽弁閉鎖不全症に対する後尖patch augumentationの遠隔成績 | 心臓血管外科 | 吉田 一史 | 2023/3/30 | |
| 研22244 | 発症前併存疾患指数を含む、主幹動脈閉塞症に対する緊急再開通治療後の臨床転帰予測モデルの作成 | 脳神経内科 | 藤原 悟 | 2023/3/31 | |
| 研22240 | 外傷性腋窩動脈損傷に関する研究 | 整形外科 | 光澤 定己 | 2023/3/29 | |
| 研22239 | 外傷性膝窩動脈損傷に関する研究 | 整形外科 | 光澤 定己 | 2023/3/29 | |
| 研22232 | 同種造血幹細胞移植におけるオランザピンの制吐効果と安全性に関する検討 | 血液内科 | 石川 隆之 | 2023/3/15 | |
| 研22225 | 関節リウマチに伴う気管支拡張症の全国調査研究 | 呼吸器内科 | 富井 啓介 | 2023/2/27 | |
| 研22222 | 局所進行非小細胞肺癌に対する化学放射線療法を受けた患者の後ろ向き研究(HOPE-005/CRIMSON)に付随する画像評価の検討 | 呼吸器内科 | 佐藤 悠城 | 2023/2/20 | |
| 研22221 | 転移性腎細胞癌の日本人患者を対象に一次治療におけるアベルマブ・アキシチニブ併用療法の実臨床での有用性を評価する多機関共同・非介入・後ろ向き観察研究:J-DART2 | 泌尿器科 | 山﨑 俊成 | 2023/2/16 | |
| 研22219 | 85歳以上の超高齢者に対する胃ESDの安全性と妥当性に関する多機関共同後ろ向き観察研究 | 消化器内科 | 籔内 洋平 | 2023/2/10 | |
| 研22217 | 腹腔洗浄細胞診陽性膵癌に対し切除の是非を明らかにするための比較研究 | 外科 | 貝原 聡 | 2023/2/10 | |
| 研22216 | 膵腫瘍に対する超音波内視鏡下穿刺吸引生検 (EUS-FNA) 後の穿刺経路腫瘍細胞播種( Needle tract seeding )の前向き全国調査 | 消化器内科 | 和田 将弥 | 2023/2/14 | |
| 研22215 | 腎機能が低下している急性骨髄性白血病患者におけるベネトクラクス及びアザシチジン併用療法の有効性と安全性についての検討 | 血液内科 | 近藤 忠一 | 2023/2/8 | |
| 研22214 | 髄膜炎・脳炎の急性期診療における髄液多項目PCRパネル(FilmArray MEパネル)の有用性:後向きコホート研究 | 脳神経内科 | 藤原 悟 | 2023/2/8 | |
| 研22212 | ICU患者の退院時と外来受診時のPICSの変化について | リハビリテーション技術部 | 岩田 健太郎 | 2023/1/31 | |
| 研22211 | 間質性肺疾患患者における認知症の有無は180日再入院率に影響を及ぼすか | リハビリテーション技術部 | 岩田 健太郎 | 2023/2/6 | |
| 研22208 | 内胸リンパ節領域を標的に含まない領域リンパ節照射を伴う乳癌手術後放射線療法の治療成績の検討 | 放射線治療科 | 小久保 雅樹 | 2023/2/1 | |
| 研22205 | 病院附属の保育園から病院内へのCOVID-19感染の影響に関する記述疫学研究 | 感染症科 | 土井 朝子 | 2023/1/26 | |
| 研22204 | DPCデータ及び各レセプトデータ上の妊娠の転帰を特定するvalidation研究 | 産婦人科 | 吉岡 信也 | 2023/2/1 | |
| 研22199 | 心不全患者に対する、トルバプタン投与による急激な血清ナトリウム濃度変動のリスク予測モデルの検討 | 循環器内科 | 古川 裕 | 2023/1/18 | |
| 研22195 | 肝細胞がんに対するレンバチニブの副作用による治療中止を回避するための減量休薬の意義に関する研究 | 薬剤部 | 室井 延之 | 2023/1/16 | |
| 研22194 | 小児喘息重症度分布と治療の経年推移に関する多機関調査 | 小児科 | 岡藤 郁夫 | 2023/1/17 | |
| 研22193 | ナッツ類アレルギーの診断における新規アレルゲンコンポーネントの臨床的有用性の検討 | 小児科 | 岡藤 郁夫 | 2023/1/16 | |
| 研22192 | EGFR変異陽性肺癌患者における組織転化症例における免疫微少環境と臨床経過の検討 | 呼吸器内科 | 佐藤 悠城 | 2023/1/4 | |
| 研22188 | 本邦で診断された自己炎症性疾患の臨床情報に関する全国調査 | 小児科 | 岡藤 郁夫 | 2022/12/26 | |
| 研22187 | 日本における卵子提供による妊娠と周産期予後に関する研究―診療録を用いた全国調査研究― | 産婦人科 | 吉岡 信也 | 2022/12/21 | |
| 研22185 | 急性期脳波の異常自動検出プログラムの開発 | 脳神経内科 | 川本 未知 | 2022/12/26 | |
| 研22184 | 人工知能(AI)を用いた神経生理検査の自動判別とデータ取得 | 脳神経内科 | 幸原 伸夫 | 2022/12/15 | |
| 研22183 | 成熟B細胞リンパ腫および形質細胞腫瘍の臨床病理学的検討 | 病理診断科 | 山下 大祐 | 2022/12/15 | |
| 研22177 | アグレッシブATLにおける予後因子の検討と個別化医療の確立を目的とした全国一元化レジストリおよびバイオレポジトリの構築 | 血液内科 | 平本 展大 | 2022/12/7 | |
| 研22173 | 腎癌・腎腫瘍の臨床病理学的検討とゲノム病理データベース構築 | 病理診断科 | 原 重雄 | 2022/12/1 | |
| 研22172 | 急性白血病における体細胞遺伝子変異、腫瘍細胞のCD25発現および血中sIL-2R値の関連に関する後方視的観察研究 | 臨床検査技術部 | 丸岡 隼人 | 2022/11/30 | |
| 研22169 | 再生不良性貧血に対するエルトロンボパグの長期的影響に関する解析 | 血液内科 | 石川 隆之 | 2022/11/21 | |
| 研22164 | 「FLT3遺伝子変異を有する再発又は難治性の急性骨髄性白血病患者において,ギルテリチニブが同種造血幹細胞移植後成績に及ぼす影響」研究のためのヒストリカルデータ取得研究 | 血液内科 | 平本 展大 | 2022/11/17 | |
| 研22163 | FLT3遺伝子変異を有する再発又は難治性の急性骨髄性白血病患者における、ギルテリチニブが同種造血幹細胞移植後成績に及ぼす影響に関する観察研究 | 血液内科 | 平本 展大 | 2022/11/17 | |
| 研22161 | 循環器疾患診療実態調査(JROAD)のデータベースによる心臓サルコイドーシスの診療実態調査と二次調査に基づく診断・治療プロトコールの策定に関する研究 | 循環器内科 | 古川 裕 | 2022/11/15 | |
| 研22159 | 卵巣未熟奇形腫の悪性度を判定するバイオマーカーの同定を目指した臨床研究 | 産婦人科 | 吉岡 信也 | 2022/11/10 | |
| 研22157 | CAR-T療法後に発生するサイトカイン放出症候群の発症予測マーカーの検索 | 臨床検査技術部 | 吉田 昌弘 | 2022/11/10 | |
| 研22152 | ニボルマブ単剤治療を受けた非小細胞肺癌患者の観察研究 | 呼吸器内科 | 佐藤 悠城 | 2022/11/7 | |
| 研22150 | 固形がん患者及び血縁者における生殖細胞系列遺伝子変異同定の有用性を評価する観察研究(BRANCH study) | 腫瘍内科 | 安井 久晃 | 2022/10/31 | |
| 研22146 | 当科における早期前期破水症例の後方視的検討 | 産婦人科 | 吉岡 信也 | 2022/10/25 | |
| 研22144 | 静脈カテーテル感染症等の輸液ルート使用にかかわる実態調査 | 薬剤部 | 室井 延之 | 2022/10/17 | |
| 研22140 | 「分娩後動脈性子宮出血」の疾患概念確立のための実態調査 | 産婦人科 | 吉岡 信也 | 2022/10/5 | |
| 研22139 | 腎部分切除術を施行した腎腫瘍患者を対象に術後成績の評価を目的とした後ろ向き観察研究 | 泌尿器科 | 川喜田 睦司 | 2022/10/5 | |
| 研22134 | MRI-TRUS融合画像ガイド下経直腸前立腺標的狙撃生検と経直腸的超音波検査下生検による前立腺癌診断の有用性 | 泌尿器科 | 川喜田 睦司 | 2022/9/30 | |
| 研22132 | 非転移性去勢抵抗性前立腺癌における遠隔転移危険因子に関する検討 | 泌尿器科 | 川喜田 睦司 | 2022/9/28 | |
| 研22128 | 5-ALAを用いたPDD-TURBTにおける輝度と病理結果及び膀胱上皮内がんに対するBCG治療に関する検討 | 泌尿器科 | 川喜田 睦司 | 2022/9/26 | |
| 研22127 | 定型負荷試験食を用いた食物経口負荷試験のレジストリー研究 | 小児科 | 岡藤 郁夫 | 2022/9/26 | |
| 研22119 | トランスレーショナルリサーチによる動脈硬化関連疾患(大動脈弁狭窄症・大動脈瘤・動脈硬化性疾患)・心不全・腎不全の発症・進展のメカニズム解明 | 心臓血管外科 | 江﨑 二郎 | 2022/9/12 | |
| 研22118 | 未治療進行又は再発胃がんを対象としたニボルマブ+化学療法の実臨床下における有効性と安全性に関する観察研究 | 腫瘍内科 | 安井 久晃 | 2022/10/12 | |
| 研22116 | Stanford A型大動脈解離(AAD)術後患者に対する早期離床プロトコル導入前後におけるせん妄発症率・発症期間および誘発因子の比較 | 看護部 | 田川 早苗 | 2022/9/7 | |
| 研22112 | うっ血性心不全患者におけるエコーを用いた包括的うっ血評価と心血管イベント発症の関連 | 臨床検査技術部 | 鳥居 裕太 | 2022/9/5 | |
| 研22110 | 免疫チェックポイント阻害薬既治療進行再発肺扁平上皮癌に対する ネシツムマブ/シスプラチン/ゲムシタビン療法の 安全性と有効性を評価するための多機関後方視研究 | 呼吸器内科 | 佐藤 悠城 | 2022/9/1 | |
| 研22098 | 膣内視鏡を使った広汎子宮全摘術の安全性と有効性について | 産婦人科 | 吉岡 信也 | 2022/8/25 | |
| 研22097 | 進行・再発食道がん患者の薬物治療体系と予後に関する観察研究調査~日本におけるリアルワールドと実地臨床の分析~ | 消化器内科 | 森田 周子 | 2022/8/24 | |
| 研22093 | 脳主幹動脈閉塞症に対する緊急再開通治療における、発症前併存疾患指数と治療後転帰の関連:後向きコホート研究 | 脳神経内科 | 藤原 悟 | 2022/8/9 | |
| 研22092 | 脳卒中を含む循環器病対策の評価指標に基づく急性期医療体制の構築に関する研究 Close The Gap-Stroke J-ASPECT Study | 脳血管治療研究部 | 坂井 信幸 | 2022/8/9 | |
| 研22087 | 血液腫瘍患者におけるSARS-CoV-2感染症の転帰についての後方視的検討 | 血液内科 | 石川 隆之 | 2022/7/25 | |
| 研22085 | 周術期支援センターにおけるSGLT2阻害薬の薬学的管理 | 薬剤部 | 室井 延之 | 2022/7/21 | |
| 研22084 | VertebroBasilar Dolichoectasia の自然歴および外科的治療の成績に関する多機関共同前向き登録研究 (VERtebrobasilar DolIchoectasia Prospective Registry) VERDI study | 脳血管治療研究部 | 坂井 信幸 | 2022/7/20 | |
| 研22076 | イダルシズマブによる中和療法を受けた急性硬膜下血腫例の後方視的観察研究 | 脳血管治療研究部 | 坂井 信幸 | 2022/7/7 | |
| 研22075 | 肝被膜下血腫に対する経皮的動脈塞栓術の有効性、安全性の検討 | 放射線診断科 | 安藤 久美子 | 2022/7/7 | |
| 研22073 | 要介護1以上かつ65歳以上の慢性閉塞性肺疾患の患者に対する早期リハビリテーションと再入院との関連 | 呼吸器内科 | 富井 啓介 | 2022/7/5 | |
| 研22064 | 膀胱上皮内癌に対するBCG治療後残存腫瘍の検出におけるPDDの有効性の検討 | 泌尿器科 | 川喜田 睦司 | 2022/6/2 | |
| 研22062 | 高齢慢性腎臓病(CKD)患者の入院時modified Glasgow Prognostic Scale (mGPS)と退院時Functional Independence Measure (FIM)との関連 | リハビリテーション技術部 | 岩田 健太郎 | 2022/5/31 | |
| 研22060 | 前庭神経炎の全国疫学調査 | 耳鼻咽喉科 | 濵口 清海 | 2022/5/27 | |
| 研22058 | 膵腺房細胞癌の実態調査-多施設共同研究- | 消化器内科 | 和田 将弥 | 2022/5/20 | |
| 研22048 | 顎矯正手術後の悪心・嘔吐の予防に対するグラニセトロンおよびオンダンセトロンの有用性 | 歯科口腔外科 | 前田 圭吾 | 2022/5/12 | |
| 研22045 | びまん性大細胞型B細胞リンパ腫の患者における腫瘍細胞の表面抗原と予後の関連に関する後方視的観察研究 | 血液内科 | 石川 隆之 | 2022/5/12 | |
| 研22044 | 外来で血液培養を採取し抗菌薬開始され帰宅した患者で, 血液培養からグラム陰性桿菌が陽性になった患者の, 30日臨床治癒率について | 感染症科 | 土井 朝子 | 2022/5/9 | |
| 研22043 | 日本人脳出血患者における適切な超急性期降圧療法の探求:SAMURAI-ICH研究とATACH2試験の個別データ統合解析 | 脳血管治療研究部 | 坂井 信幸 | 2022/5/9 | |
| 研22040 | 膵 high-grade solid-pseudopapillary neoplasm の臨床・病理学的検討 | 病理診断科 | 原 重雄 |
2022/4/19 |
|
| 研22039 | 実臨床における前立腺癌治療薬アパルタミドの皮膚障害の発現状況とリスク因子の探索 | 薬剤部 | 室井 延之 | 2022/4/18 | |
| 研22037 | 全身麻酔の麻酔維持のレミマゾラムの使用はデスフルランを使用した時と比較して抜管時間を短くすることができるか | 麻酔科 | 砂田 大賀 |
2022/4/18 |
|
| 研22035 | 婦人科悪性腫瘍におけるがんパネル検査の役割:実臨床における運用実態の解明 | 産婦人科 | 青木 卓哉 |
2022/4/14 |
|
| 研22029 | 嚥下障害を有する急性脳卒中患者に対する早期積極的栄養療法の有効性の検討 | 脳神経内科 | 前川 嵩太 |
2022/4/7 |
|
| 研22025 | 日本における新型コロナウイルス(SARS-CoV-2)感染妊婦の実態把握のための多施設共同レジストリ研究 | 産婦人科 | 青木 卓哉 |
2022/4/1 |
|
| 研22024 | 血管内リンパ腫の臨床病理学的及び遺伝学的解析 | 病理診断科 | 山下 大祐 |
2022/4/5 |
|
| 研22020 | 熱性けいれんの暫定診断で入院した患者における急性脳症・脳炎の頻度と臨床的特徴に関する検討 | 小児科・新生児科 | 濱畑 啓悟 |
2022/3/28 |
|
| 研22017 | Carotid webの頻度と外科的治療の安全性、有効性に関する後方視的多機関共同研究 | 脳血管治療研究部 | 坂井 信幸 |
2022/3/29 |
|
| 研22013 | 十二指腸乳頭癌術後無再発生存期間を短縮させる臨床病理学的因子の解析:多機関共同後方視的コホート研究 | 外科 | 北村 好史 |
2022/3/23 |
|
| 研22012 | カテーテルアブレーション施行患者を対象としたTMDU 多施設レジストリ研究 | 循環器内科 | 小堀 敦志 |
2022/3/23 |
|
| 研22010 | 脾温存尾側膵切除術後長期経過症例における胃静脈瘤発生リスク因子の検討 -国内多施設共同研究- | 外科 | 貝原 聡 | 2022/3/16 | |
| 研22009 | 肝臓移植後肝癌再発高危険群の全国実態調査 | 外科・移植外科 | 貝原 聡 | 2022/3/16 | |
| 研22008 | 後腹膜脂肪肉腫再発予測因子に関する多機関共同観察研究 | 泌尿器科 | 山﨑 俊成 | 2022/3/16 | |
| 研22004 | 急性膿胸に対し胸腔鏡下手術に至った患者の予後予測因子 | 呼吸器内科 | 富井 啓介 | 2022/3/14 | |
| 研21279 | 切除不能進行・再発肺原発肉腫様癌に対する免疫チェックポイント阻害剤、あるいは化学療法と免疫チェックポイント阻害剤併用療法の有効性と安全性を検討する後ろ向きコホート研究 | 呼吸器内科 | 佐藤 悠城 | 2022/3/2 | |
| 研21278 | 急性骨髄性白血病患者の患者背景、予後と細胞表面抗原形質、体細胞遺伝子変異の関連に関する後方視的観察研究 | 血液内科 | 石川 隆之 | 2022/3/2 | |
| 研21273 | 再発卵巣癌患者の長期寛解生存に関する多施設後方視的検討 | 産婦人科 | 川田 悦子 | 2022/2/25 | |
| 研21268 | 大腿骨近位部骨折発生に関連する因子に関する研究 | 整形外科 | 安田 義 | 2022/2/21 | |
| 研21267 | NELL1陽性膜性腎症の臨床病理学的特徴に関する研究 | 病理診断科 | 原 重雄 | 2022/2/21 | |
| 研21266 | EGFR遺伝子L858R変異陽性進行再発非扁平上皮非小細胞肺癌におけるTP53遺伝子変異の意義および治療耐性メカニズムの検討 | 呼吸器内科 | 佐藤 悠城 | 2022/2/21 | |
| 研21264 | 間質性腎炎のIgG subclassに関する研究 | 病理診断科 | 原 重雄 | 2022/2/18 | |
| 研21262 | 本邦における子宮体癌に対する低侵襲手術(MIS)の実態調査 | 産婦人科 | 青木 卓哉 | 2022/2/17 | |
| 研21256 | アグレッシブNK 細胞白血病に関する多機関共同後方視的研究 ANKL22 | 血液内科 | 石川 隆之 | 2022/2/7 | |
| 研21254 | 人工膝関節置換術施行前の筋肉量と術後3ヶ月の身体機能および疼痛との関連 | リハビリテーション技術部 | 岩田 健太郎 | 2022/1/31 | |
| 研21252 | 切除不能尿路上皮癌の治療に関する多機関共同観察研究 | 泌尿器科 | 川喜田 睦司 | 2022/1/31 | |
| 研21246 | COVID-19抗体検出試薬・サイトカイン関連試薬の性能評価 | 呼吸器内科 | 富井 啓介 | 2022/1/20 | |
| 研21239 | Push dose pressorsとしてのnorepinephrineの有効性効果 | 救急科 | 白川 和宏 | 2022/1/12 | |
| 研21238 | 新世代治療導入後の未治療NK/T細胞リンパ腫における治療実態とその推移および予後に関する国内多機関共同調査研究 (NKEA-Next project) | 放射線治療科 | 小久保 雅樹 | 2022/1/12 | |
| 研21237 | 一般社団法人 National Clinical Database における手術・治療情報データベース事業 | 産婦人科 | 吉岡 信也 | 2022/1/17 | |
| 研21236 | 一般社団法人 National Clinical Database における手術・治療情報データベース事業 | 泌尿器科 | 川喜田 睦司 | 2022/1/17 | |
| 研21235 | 一般社団法人 National Clinical Database における手術・治療情報データベース事業 | 心臓血管外科 | 小山 忠明 | 2022/1/17 | |
| 研21234 | 一般社団法人 National Clinical Database における手術・治療情報データベース事業 | 消化器外科、移植外科 | 貝原 聡 | 2022/1/17 | |
| 研21233 | 一般社団法人 National Clinical Database における手術・治療情報データベース事業 | 耳鼻咽喉科・頭頸部外科 | 篠原 尚吾 | 2022/1/17 | |
| 研21232 | 一般社団法人 National Clinical Database における手術・治療情報データベース事業 | 循環器内科 | 古川 裕 | 2022/1/17 | |
| 研21231 | 一般社団法人 National Clinical Database における手術・治療情報データベース事業 | 形成外科 | 片岡 和哉 | 2022/1/17 | |
| 研21230 | 一般社団法人 National Clinical Database における手術・治療情報データベース事業 | 呼吸器外科 | 浜川 博司 | 2022/1/17 | |
| 研21229 | 一般社団法人 National Clinical Database における手術・治療情報データベース事業 | 乳腺外科 | 鈴木 栄治 | 2022/1/17 | |
| 研21226 | 進行・再発非小細胞肺癌のバイオマーカー検査と標的治療に関する実態調査プロジェクト | 呼吸器内科 | 佐藤 悠城 | 2022/1/6 | |
| 研21225 | カテーテルアブレーション全国症例登録研究 [J-AB 2022] | 循環器内科 | 小堀 敦志 | 2021/12/28 | |
| 研21223 | リハビリテーション動画による運動機能計測に基づいた人工知能運動機能推定技術の開発 | リハビリテーション科 | 幸原 伸夫 | 2021/12/28 | |
| 研21222 | 子宮肉腫予後予測における治療前炎症性バイオマーカーの有用性に関する研究 | 産婦人科 | 吉岡 信也 | 2021/12/28 | |
| 研21221 | 前立腺がんに対するロボット支援根治的前立腺全摘術の多機関共同観察研究 | 泌尿器科 | 川喜田 睦司 | 2021/12/28 | |
| 研21219 | 頭頸部の希少腫瘍における疫学、経過、治療成績、および予後の検証 | 耳鼻咽喉科・頭頸部外科 | 篠原 尚吾 | 2021/12/22 | |
| 研21211 | 食物アレルギーにおけるIgD・IgG4抗体の役割の検討 | 小児科 | 岡藤 郁夫 | 2021/12/9 | |
| 研21210 | 悪性リンパ腫に対する自家造血幹細胞移植と放射線治療の調査研究 | 放射線治療科 | 小久保 雅樹 | 2021/12/8 | |
| 研21207 | OCV-501の第II相臨床試験の予後追跡調査試験(OCV-501長期観察研究) | 血液内科 | 石川 隆之 | 2021/12/8 | |
| 研21205 | 肥大型心筋症患者における診療の実態調査および突然死/拡張相への移行に関する新規予測プログラムの開発とその検証のための多施設後向き登録研究 | 循環器内科 | 古川 裕 | 2021/11/29 | |
| 研21201 | 心房性機能性僧帽弁逆流の疫学および治療の意義に関する多施設後方視的観察研究 | 循環器内科 | 岡田 大司 | 2021/11/26 | |
| 研21198 | 京都大学医学部附属病院腎臓内科 関連病院腎疾患データベース構築に関する観察研究 | 腎臓内科 | 吉本 明弘 | 2021/11/18 | |
| 研21177 | IV期肺癌患者における予後を含めた実態調査:多施設後ろ向きレジストリ研究【WJOG15121L】 | 呼吸器内科 | 佐藤 悠城 | 2021/10/21 | |
| 研21172 | SARS-CoV-2感染症における心臓バイオマーカーを用いた予後予測法の探索(COVID-MI) | 循環器内科 | 豊田 俊彬 | 2021/10/12 | |
| 研21169 | 軟部血管線維腫を対象とした診断に有用な免疫組織マーカーの探索に関する観察研究 | 病理診断科 | 原 重雄 | 2021/10/6 | |
| 研21167 | 膿胸の治療法選択に有用な膿胸腔範囲診断法の確立のための研究 | 呼吸器内科 | 富井 啓介 | 2021/9/28 | |
| 研21161 | COVID-19感染の診療への影響調査と予測モデル開発 | 医療情報部 | 猪熊 哲朗 | 2021/9/21 | |
| 研21159 | 静脈血栓塞栓症患者の診療実態とその予後を検討する多施設ヒストリカルコホート研究 COMMAND VTE Registry 2 | 循環器内科 | 金 基泰 | 2021/9/17 | |
| 研21147 | 同種造血幹細胞移植患者におけるヘモグロビン値の変動に影響を及ぼす因子の探索 | 薬剤部 | 橋田 亨 | 2021/8/30 | |
| 研21137 | 機械的血栓回収療法を受けた急性期脳梗塞患者における血管壁イメージングを用いた脳血管評価に関する臨床研究 (VWI研究) | 脳神経内科 | 尾原 信行 | 2021/8/16 | |
| 研21134 | 特発性好酸球増加症候群の診療ガイドライン作成に向けた疫学研究(多施設共同後方視的調査研究) | 脳神経内科 | 石井 淳子 | 2021/8/16 | |
| 研21131 | 急性期脳梗塞患者におけるリハビリテーション時の頭位挙上角度の変化が脳酸素動態に与える影響 | リハビリテーション技術部 | 岩田 健太郎 | 2021/8/30 | |
| 研21119 | 希少ドライバー遺伝子異常をもつ肺癌患者の後方視的調査 | 呼吸器内科 | 佐藤 悠城 | 2021/7/15 | |
| 研21116 | 心不全患者において対処行動パターンが疾病管理状況及び予後に与える影響 | リハビリテーション技術部 | 岩田 健太郎 | 2021/7/15 | |
| 研21110 | 後腹膜鏡下腎尿管全摘術後のドレーン留置の必要性についての検討 | 泌尿器科 | 川喜田 睦司 | 2021/6/29 | |
| 研21108 | 泌尿器癌に対する薬物療法における薬剤師外来の有用性に関する検討 | 薬剤部 | 室井 延之 | 2021/6/29 | |
| 研21106 | Spinal extradural arteriovenous fistulaの分類と各疾患群における臨床症状、血管構築、治療成績の検討:全国調査 | 脳神経外科 | 坂井 信幸 | 2021/6/29 | |
| 研21105 | まむし抗毒素によるアナフィラキシー反応予防を目的としたアドレナリン投与の有用性および安全性に関する調査 | 薬剤部 | 室井 延之 | 2021/6/29 | |
| 研21104 | 子宮筋腫と子宮肉腫を術前に鑑別するアルゴリズム作成のための研究 | 産婦人科 | 吉岡 信也 | 2021/6/29 | |
| 研21089 | COVID-19の病態解析・重症化のメカニズムの解明 | 呼吸器内科 | 富井 啓介 | 2021/6/17 | |
| 研21083 | グリオーマにおける化学療法感受性の遺伝子指標の検索とそれに基づくテーラーメード治療法の開発 | 脳神経外科 | 坂井 信幸 | 2021/6/15 | |
| 研21066 | 進行固形悪性腫瘍患者に対するAI マルチオミックスを活用したバイオマーカー開発の多施設共同研究 (SCRUM-Japan MONSTAR-SCREEN-2) |
腫瘍内科 | 安井 久晃 | 2021/6/3 | |
| 研21064 | 重症虚血性僧帽弁閉鎖不全症に対する乳頭筋に介入した僧帽弁形成術の有用性に関する多施設共同研究(通称:MITRA PLUS) | 心臓血管外科 | 江﨑 二郎 | 2021/6/1 | |
| 研21063 | 動脈硬化性の急性頭蓋内主幹動脈閉塞に対する血管内治療に関する後ろ向き登録調査(RESCUE-Japan-ATBI) | 脳血管治療研究部 | 坂井 信幸 | 2021/6/2 | |
| 研21056 | pT1aN0M0腎癌の転移再発に関する観察研究 | 泌尿器科 | 山﨑 俊成 | 2021/5/26 | |
| 研21055 | 未治療進行または再発非小細胞肺がんを対象としたニボルマブ+イピリムマブ±化学療法併用療法の日本における治療実態および有効性と安全性に関する観察研究(LIGHT-NING) | 呼吸器内科 | 佐藤 悠城 | 2021/5/26 | |
| 研21052 | 多施設後ろ向き研究による脊椎脊髄手術の傾向と推移に関する大規模調査 | 整形外科 | 大西 英次郎 | 2021/5/26 | |
| 研21049 | 救急外来における処置時の鎮痛鎮静に対する多施設前向き観察研究 | 救急科 | 出田 健人 | 2021/5/21 | |
| 研21046 | 動体追尾肝定位放射線治療の多施設前向き観察研究 | 放射線治療科 | 小久保 雅樹 | 2021/5/12 | |
| 研21045 | 経皮的左心耳閉鎖システムを用いた非弁膜症性心房細動患者の塞栓予防の有効性と安全性に関する多施設レジストリー研究 -J-LAAO- | 循環器内科 | 江原 夏彦 | 2021/5/12 | |
| 研21042 | 経口糖尿病薬SGLT2阻害薬が術後アシドーシスに与える影響 | 薬剤部 | 室井 延之 | 2021/4/26 | |
| 研21039 | 前立腺癌骨転移に対する治療効果と去勢抵抗性前立腺癌に至るまでの期間の相関性の検討;骨シンチグラフィー解析ソフト(VSBONE,GIBONE)を用いた評価 | 泌尿器科 | 川喜田 睦司 | 2021/4/26 | |
| 研21036 | ラクナ梗塞発症後48時間以内に増悪する患者の来院時MRI画像を用いたAIモデルの構築 | 脳神経内科 | 前川 嵩太 | 2021/4/26 | |
| 研21007 | 壊死性軟部組織感染症における早期外科介入と患者予後との関連性 | 救急科 | 松岡 由典 | 2021/3/23 | |
| 研21006 | プラチナ感受性初回再発卵巣癌に対するオラパリブ維持療法の安全性と有効性を検討するヒストリカルコホート研究 | 産婦人科 | 吉岡 信也 | 2021/3/23 | |
| 研20262 | 大動脈弁形成術に対する全国アンケート調査 | 心臓血管外科 | 小山 忠明 | 2021/2/19 | |
| 研20260 | 京都大学および関連施設における膠芽腫症例に関する後方視的解析 | 脳神経外科 | 坂井 信幸 | 2021/2/8 | |
| 研20258 | 経口血管新生阻害薬による蛋白尿発現のリスク因子に関する検討 | 薬剤部 | 室井 延之 | 2021/2/8 | |
| 研20256 | 血管内B細胞リンパ腫における多施設共同後方視的研究 | 血液内科 | 下村 良充 | 2021/2/4 | |
| 研20210 | 難治性聴覚障害に関する調査研究(2020年版) | 耳鼻咽喉科 | 内藤 泰 | 2020/12/22 | |
| 研20195 | 脳卒中の急性期診療提供体制の変革に係る実態把握及び有効性等の検証のための研究 | 脳血管治療研究部 | 坂井 信幸 | 2020/12/10 | |
| 研20191 | ロボット支援腹腔鏡下前立腺全摘除術(RARP)の治療実態調査 | 泌尿器科 | 川喜田 睦司 | 2020/12/9 | |
| 研20189 | 出血性脳卒中に対する人工知能を用いた画像解析技術の開発と有用性の評価 | 脳血管治療研究部 | 坂井 信幸 | 2020/12/5 | |
| 研20188 | 脳梗塞及び主幹動脈閉塞を対象とした画像診断支援技術の開発と有用性の評価 | 脳血管治療研究部 | 坂井 信幸 | 2020/12/5 | |
| 研20159 | 補助循環用ポンプカテールに関するレジストリ事業 | 循環器内科 | 古川 裕 | 2020/10/27 | |
| 研20142 | 新型コロナ肺炎の胸部単純レントゲン写真の自動診断 | 放射線診断科 | 石藏 礼一 | 2020/10/8 | |
| 研20134 | FREDを用いた脳動脈瘤に対するフローダイバーター留置術の市販後初期経験に関する多施設共同登録研究 | 脳血管治療研究部 | 坂井 信幸 | 2020/9/24 | |
| 研20125 | COVID-19の予後予測因子の同定と臨床応用に関する研究 | 呼吸器内科 | 富井 啓介 | 2020/9/10 | |
| 研20117 | 新型コロナウイルス感染症の重症化機構の解明 | 呼吸器内科 | 富井 啓介 | 2020/9/2 | |
| 研20114 | びまん性肺疾患の疫学およびバイオマーカーに関する研究 | 呼吸器内科 | 富井 啓介 | 2020/9/1 | |
| 研20113 | 新型コロナウイルス感染症(COVID-19)の臨床的、画像的特徴についての検討 | 呼吸器内科 | 佐藤 悠城 | 2020/8/29 | |
| 研20107 | COVID-19症例での栄養状態と重症化の関連について | 麻酔科 | 東別府 直紀 | 2020/8/22 | |
| 研20103 | 当院における尿道12時粘膜温存BipolEPの有効性について 非温存BipolEP&TUEB&HoLEPとの比較検討 | 泌尿器科 | 川喜田 睦司 | 2020/8/15 | |
| 研20096 | 京都大学医学部附属病院ならびに関連病院における泌尿器疾患の観察研究 | 泌尿器科 | 川喜田 睦司 | 2020/8/8 | |
| 研20090 | 集中治療室入室患者における末梢皮膚穿刺採血と動脈ライン採血による血液培養のコンタミネーション割合の比較 | 麻酔科 | 土田 高裕 | 2020/8/4 | |
| 研20052 | 人工知能を利用した肥大型心筋症の心臓MRI画像自動診断システムの開発(AIHCM2) | 循環器内科 | 金 基泰 | 2020/6/11 | |
| 研20028 | COVID-19に関するレジストリ研究 | 呼吸器内科 | 中川 淳 | 2020/5/23 | |
| 研20021 | 新型コロナウイルス感染症における神経学的異常及び神経筋疾患の特徴と神経学的予後の検討 | 脳神経内科 | 川本 未知 | 2020/5/19 | |
| 研20015 | EGFR遺伝子変異陽性非小細胞肺癌に対する初回治療Osimertinibの多施設実態調査 | 呼吸器内科 | 佐藤 悠城 | 2020/5/16 | |
| 研20014 | 未治療移植適応多発性骨髄腫患者を対象にしたボルテゾミブを用いた寛解導入・地固め・維持療法および大量抗がん剤併用自家末梢血幹細胞移植の安全性と有効性の検討:追加後方視的研究 | 血液内科 | 吉岡 聡 | 2020/5/16 | |
| 研20011 | 造血幹細胞移植における赤血球数変動を考慮した免疫抑制剤タクロリムスの全血中濃度予測 | 薬剤部 | 橋田 亨 | 2020/5/13 | |
| 研20010 | 視神経炎における画像解析と臨床症状・治療経過との関連に関する検討 | 眼科 | 平見 恭彦 | 2020/5/13 | |
| 研20007 | 人工内耳装用者の包括的な聴覚関連脳機能検査法の開発に資する研究 | 臨床研究推進センター・難聴研究部 | 山本 典生 | 2020/5/8 | |
| 研20005 | 血液循環腫瘍DNA 陰性の高リスクStage II 及び低リスクStage III 結腸癌治癒切除例に対する術後補助化学療法としてのCAPOX 療法と手術単独を比較するランダム化第III 相比較試験 VEGA trial | 腫瘍内科 | 安井 久晃 | 2020/5/1 | |
| 研19287 | 根治的外科治療可能の結腸・直腸癌を対象としたレジストリ研究 GALAXY trial | 腫瘍内科 | 安井 久晃 | 2020/4/18 | |
| 研19282 | 人工内耳装用者の音声リハビリテーションの開発に資する研究 | 耳鼻咽喉科 | 山本 典生 | 2020/4/11 | |
| 研19281 | 骨シンチグラフィにおける正常骨SUVの検討 | 放射線技術部 | 清水 敬二 | 2020/4/8 | |
| 研19279 | コロナウィルス肺炎(CoVP)とインフルエンザウィルス肺炎(InVP)、非ウィルス性市中肺炎(nVCAP)の臨床像に関する多施設共同研究 | 呼吸器内科 | 富井 啓介 | 2020/4/7 | |
| 研19278 | バンコマイシン投与患者の治療関連データベースの構築とそれを利用した体内動態に対する影響因子の抽出および母集団パラメータの最適化の拡大調査 | 薬剤部 | 橋田 亨 | 2020/4/7 | |
| 研19273 | 内視鏡外科手術の多施設データベース構築 | 外科 | 橋田 裕毅 | 2020/4/2 | |
| 研19265 | 再発高リスク消化管間質腫瘍に対する完全切除後の治療に関する研究 (STAR ReGISTry)の追跡調査 | 外科 | 近藤 正人 | 2020/3/23 | |
| 研19258 | レセプト等情報を用いた脳卒中、脳神経外科医療疫学調査 J-ASPECTstudy(Nationwide survey of Acute Stroke care capacity for Proper Designation of Comprehensive stroke center in Japan | 脳神経外科 | 太田 剛史 | 2020/3/14 | |
| 研19252 | 急性非代償性心不全の実態に関する多施設観察研究 | 循環器内科 | 岡田 大司 | 2020/3/7 | |
| 研19248 | 進展型小細胞肺癌患者に対する初回治療カルボプラチン/エトポシド/アテゾリズマブ併用療法の実地診療における有効性、安全性を検討する多施設前向き観察研究に付随するバイオマーカー研究 | 呼吸器内科 | 富井 啓介 | 2020/3/3 | |
| 研19237 | 本邦における院外心停止患者に対するExtracorporeal Cardiopulmonary Resuscitation (ECPR)に関する多施設後ろ向き観察研究(SAVE-J II study) | 救命救急センター | 松岡 由典 | 2020/2/13 | |
| 研19221 | 小児脳のCT標準脳作成 | 放射線診断科 | 安藤 久美子 | 2020/1/18 | |
| 研19205 | 発症時刻不明脳梗塞に対する静注血栓溶解療法の多施設共同観察研究 THAWS 2 |
脳神経外科 | 坂井 信幸 | 2019/12/21 | |
| 研19195 | 消化器内視鏡に関連する疾患、治療手技データベース構築 | 消化器内科 | 猪熊 哲朗 | 2019/12/3 | |
| 研19191 | 日本整形外科学会症例レジストリー(JOANR)構築に関する研究 | 整形外科 | 安田 義 | 2019/12/3 | |
| 研19187 | ホルモン感受性転移性前立腺癌の治療実態に関する前向き観察研究 | 泌尿器科 | 川喜田 睦司 | 2019/11/30 | |
| 研19179 | 睡眠中発症もしくは発症時刻不明脳梗塞に対するアルテプラーゼ静注血栓溶解療法試験の個別データ統合解析 Evaluation of unknown Onset Stroke thrombolysis trials(EOS) | 脳神経外科 | 坂井 信幸 | 2019/11/23 | |
| 研19172 | 日本人固形癌患者におけるMSI-High発現状況とペムブロリズマブ投与時の有効性および安全性の検討 | 薬剤部 | 橋田 亨 | 2019/11/16 | |
| 研19170 | 当院における唾液腺癌に対する術後放射線療法の治療成績 | 放射線治療科 | 光吉 隆真 | 2019/11/13 | |
| 研19166 | 局所進行非小細胞肺癌に対する化学放射線療法を受けた患者の後ろ向き研究 | 呼吸器内科 | 佐藤 悠城 | 2019/11/8 | |
| 研19155 | 我が国における再照射の現状実態調査 | 放射線治療科 | 小倉 健吾 | 2019/10/19 | |
| 研19144 | 治癒切除不能な固形悪性腫瘍における血液循環腫瘍DNAのがん関連遺伝子異常及び腸内細菌叢のプロファイリング・モニタリングの多施設共同研究 (SCRUM-Japan | 腫瘍内科 | 安井 久晃 | 2019/10/4 | |
| 研19142 | 経カテーテル大動脈弁植込み術症例における大動脈弁狭窄症の病型ならびにその予後に関する調査 | 循環器内科 | 北井 豪 | 2019/10/4 | |
| 研19136 | 切除不能ステージⅢ非小細胞肺癌患者における同時化学放射線療法後のデュルバルマブの長期安全性および有効性に関する観察研究【AYAME study】 | 呼吸器内科 | 佐藤 悠城 | 2019/9/28 | |
| 研19121 | 進展型小細胞肺癌患者に対する初回治療カルボプラチン/エトポシド/アテゾリズマブ併用療法の実地診療における有効性、安全性を検討する多施設前向き観察研究 | 呼吸器内科 | 佐藤 悠城 | 2019/9/20 | |
| 研19098 | 超音波検査画像活用卵巣がん早期診断AI開発 | 産婦人科 | 吉岡 信也 | 2019/8/20 | |
| 研19097 | 進行肺がん患者における分子標的治療の止め時に関する多施設観察研究 | 呼吸器内科 | 佐藤 悠城 | 2020/1/18 | |
| 研19081 | 電子的診療録の自動構造化を有した自然言語処理解析装置の研究開発 | 脳神経内科 | 尾原 信行 | 2019/7/25 | |
| 研19079 | 経皮的僧帽弁接合不全修復システムを用いた僧帽弁閉鎖不全に対する治療介入の有効性と安全性に関する多施設レジストリー研究 | 循環器内科 | 江原 夏彦 | 2019/7/23 | |
| 研19048 | 脳血流解析ソフトの精度検証と精度向上に関する研究 | 脳神経外科 | 今村 博敏 | 2019/6/6 | |
| 研19019 | 非小細胞肺がん患者における免疫チェックポイント阻害薬の薬物動態モデルの構築 | 薬剤部 | 橋田 亨 | 2019/4/12 | |
| 研18208 | 脳腫瘍全国統計調査と解析(臓器がん登録調査) | 脳神経外科 | 太田 剛史 | 2019/2/13 | |
| 研18202 | 眼内レンズ挿入眼の視機能評価の後ろ向き研究 | 眼科 | 栗本 康夫 | 2019/1/24 | |
| 研18179 | 妊娠に伴う合併症の早期診断に役立つバイオマーカーと新規治療法の探索 | 産婦人科 | 吉岡 信也 | 2018/12/14 | |
| 研18147 | 結腸・直腸癌を含む消化器・腹部悪性腫瘍患者を対象としたリキッドバイオプシーに関する研究;GI-screen付随研究 GOZILA study | 腫瘍内科 | 安井 久晃 | 2018/10/30 | |
| 研18143 | フェンタニルの併用によるワルファリンの作用増強についての検討 多施設共同後方視的観察研究 |
薬剤部 | 橋田 亨 | 2018/10/26 | |
| 研18118 | 前立腺がんに対する強度変調放射線治療の多施設前向き登録 | 放射線治療科 | 小久保 雅樹 | 2018/8/23 | |
| 研18101 | 成人市中発症肺炎(COP)における肺炎球菌性肺炎の疫学研究 | 呼吸器内科 | 富井 啓介 | 2018/7/26 | |
| 研18089 | 糖尿病合併卵巣がん患者におけるdose-dense TC療法の有効性および安全性の評価 | 薬剤部 | 室井 延之 | 2018/6/29 | |
| 研18068 | 京都大学外科関連多施設における胃癌手術レジストリ | 外科 | 小林 裕之 | 2018/6/1 | |
| 研18051 | 京都造血幹細胞移植グループの造血幹細胞移植データを用いた移植成績の解析 | 血液内科 | 石川 隆之 | 2018/5/17 | |
| 研18003 | 気管支喘息患者における血清ペリオスチンの予後予測能の検討 | 呼吸器内科 | 富井 啓介 | 2018/3/6 | |
| 研17194 | 血液凝固異常症全国調査 | 小児科 | 濱畑 啓悟 | 2017/12/9 | |
| 研17167 | 高リスク前立腺癌に対する術前補助化学内分泌療法の有効性についての検討 | 泌尿器科 | 川喜田 睦司 | 2017/11/14 | |
| 研17098 | SCRUM-Japan疾患レジストリを活用した新薬承認審査時の治験対照群データ作成のための前向き多施設共同研究 | 呼吸器内科 | 富井 啓介 | 2017/9/8 | |
| 研17096 | 緑内障の治療前因子と治療効果の後ろ向き研究 | 眼科 | 栗本 康夫 | 2017/9/5 | |
| 研17041 | 日本における頭頸部悪性腫瘍登録事業の実施 | 頭頸部外科 | 篠原 尚吾 | 2017/8/9 | |
| 研17020 | 小児への皮下免疫療法における治療効果と免疫応答の関連についての観察研究 | 小児科 | 岡藤 郁夫 | 2017/11/28 | |
| 研16115 | 脳卒中研究者新ネットワークを活用した脳・心血管疾患における抗血栓療法の実態と安全性の解明 The Bleeding with Antithrombotic Therapy Study BAT 2 | 脳神経内科 | 尾原 信行 | 2016/12/16 | |
| 研16107 | ケロイドの診断・治療におけるケロイド発現蛋白の機能と有用性 | 形成外科 | 池田 実香 | 2016/11/25 | |
| 研16090 | フローダイバーターの有効性と安全性に関する全国悉皆調査 | 脳神経外科 | 坂井 信幸 | 2016/10/22 | |
| 研16081 | 日本における成人心臓血管外科手術のレジストリ Japanese Registry of Adult Cardiovascular Surgery |
心臓血管外科 | 小山 忠明 | 2016/10/1 | |
| 研16060 | 脳卒中後てんかんの内科的治療予防効果及び再発予測因子の検証に関する前方視的研究 | 脳神経内科 | 吉村 元 | 2016/9/28 | |
| 研16056 | 心房細動合併患者における冠動脈インターベンション施行後の抗血栓療法の実態調査 REVEAL AF-PCI Registry: Real-world evaluation of the antithrombotic therapy and clinical outcomes for the patients with atrial fibrillation undergoing percutaneous coronary intervention |
循環器内科 | 古川 裕 | 2016/8/16 | |
| 研16053 | 日本産科婦人科内視鏡学会における手術および合併症登録 | 産婦人科 | 吉岡 信也 | 2016/8/16 | |
| 研16028 | 日本集中治療医学会主催のICU入室患者登録システム事業への参画:患者情報システムを用いた集中治療部の機能評価 (JIPAD事業) | 救急科 | 瀬尾 龍太郎 | 2016/6/14 | |
| 研14999 | 疫学調査「血液疾患登録」 | 血液内科 | 石川 隆之 | 2013/11/30 | |
| 研14133 | 急性期脳卒中症例の諸因子と転帰との関連についての調査研究 | 脳神経外科 | 坂井 信幸 | 2015/2/25 | |
| 研14080 | JAAM多施設共同院外心停止レジストリ | 救急部 | 有吉 孝一 | 2014/10/21 | |
| 研14041 | レセプトおよびDPCデータを用いた循環器疾患における医療の質に関する研究 | 循環器内科 | 古川 裕 | 2014/7/5 | |
| 研12999 | 日本産婦人科学会周産期委員会 周産期登録事業および登録情報に基づく研究 | 産婦人科 | 青木 卓哉 | 2012/10/25 | |
| 研12997 | 日本産科婦人科学会婦人科腫瘍委員会 婦人科悪性腫瘍登録事業及び登録情報に基づく研究 | 産婦人科 | 青木 卓哉 | 2012/10/1 | |
| 研12091 | 腎盂尿管癌術後膀胱内再発に対する塩酸ピラルビシン即時膀胱内単回注入療法の再発予防効果に関する検討 | 泌尿器科 | 川喜田 睦司 | 2012/10/1 | |
| 研9062 | 網膜硝子体疾患の治療前因子と治療効果の後ろ向き研究 | 眼科 | 平見 恭彦 | 2009/6/10 | |
| 研187 | 造血器腫瘍における遺伝子異常の網羅的解析 | 血液内科 | 平本 展大 | 2015/9/4 |
リンク集
当院に関する情報
神戸市立医療センター中央市民病院
神戸市立医療センター中央市民病院 各種審査委員会
神戸医療産業都市
治験に関する一般情報
厚生労働省のウェブサイト 医薬品医療機器総合機構(PMDA) 日本製薬工業協会その他
KOBEもの忘れネットワーク「認知症」に関する臨床試験や治験にご協力いただける方の登録を受付けています。