病名、病気の性質、状態、期待される治療効果、予後および今後の治療方針について、詳しい説明を行うのはもちろんですが、医師と患者さんが話し合いながら治療法を決定します。インフォームド・コンセントのように情報の流れは一方向でなく、医師は患者さんの特性をつかみながら、自由に個人的意見も言える関係の中でお互いが納得できる治療方針を一緒に決定するというプロセスを大切にしたいと考えています。
患者さんご本人には十分理解、納得していただいた上で治療を行いますが、最初に受診される場合は、ご本人だけではなく、可能な限りご家族と一緒に来院されることをお勧めいたします。
治療法としては特別な理由がない限りは標準治療をまず検討します。標準治療とは「現時点でその治療を行うことが、最も良い効果が出る可能性が高い」ことが、臨床試験で証明され、医学的・科学的根拠に妥当であるとされた治療法です(当然新しい治療法の出現により変わることがあります)。さらに、患者さんの全身状態や治療法により副作用の違い、患者さんの希望やその他の状況なども考慮し、患者さんにとって最良の治療を提案させていただきます。
臨床試験として、新薬の治験、新しい併用化学療法などの研究的治療にも取り組んでいます。希望のある患者さんは治験や臨床試験に参加することで、新たな治療法を先取りし選択できる場合もありますので、治療説明の際に希望される方にはお話させていただいております。
QOL(生活の質)を重視し、化学療法を導入した後は、当院外来もしくは地域の連携医療機関で治療を継続していきます。可能な限り今までの生活が続けられるように心がけています。
また、当院外来化学療法センターでは、各分野の専門医、さらにはがん専門看護師、がん化学療法認定看護師、がん専門薬剤師と協働し、安全で快適な外来化学療法の実施に努めております。
当科では、消化器がんをはじめとする成人固形がんの患者さんに対する先進的なチーム医療を行っています。
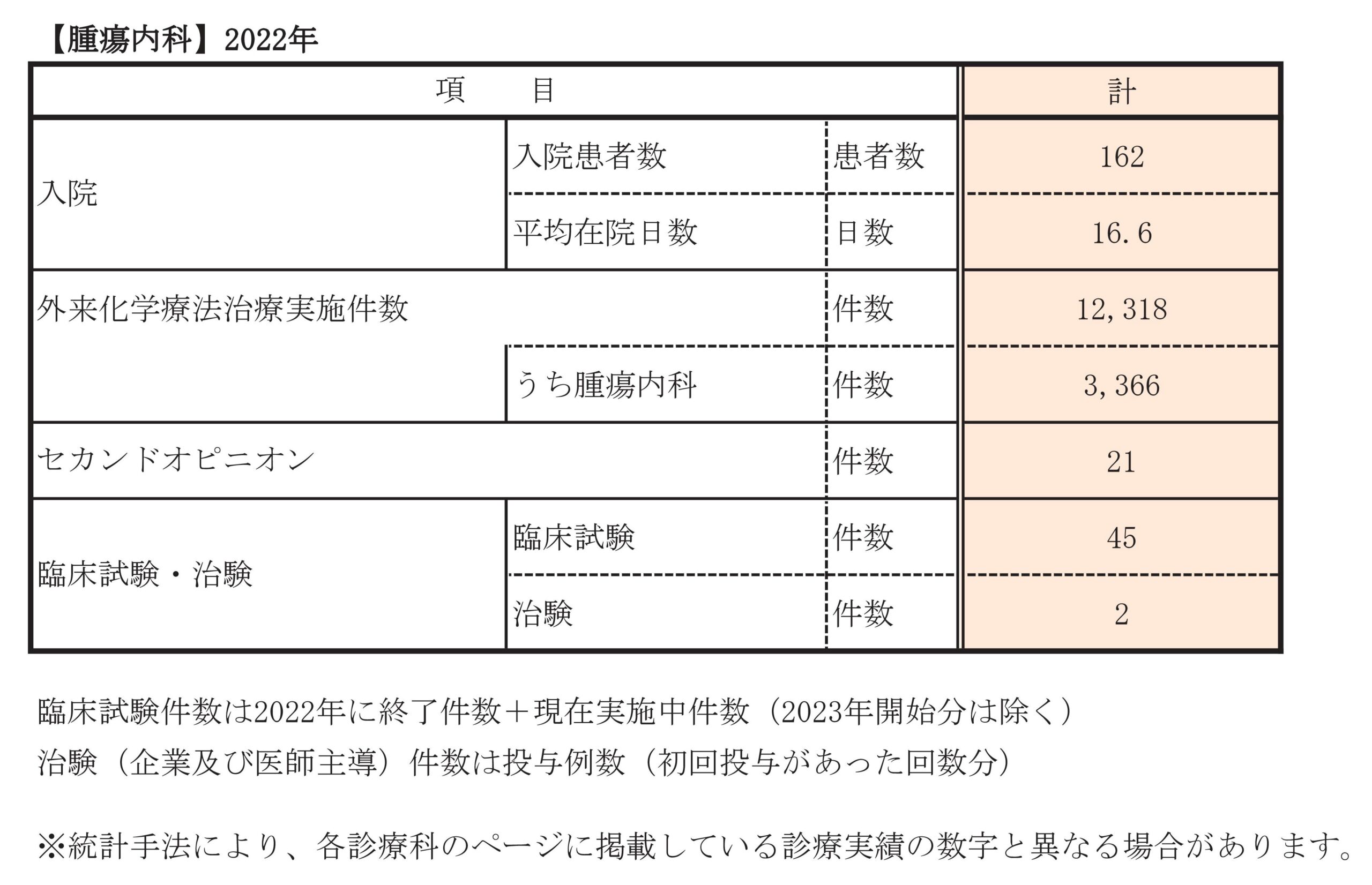
診療実績
外来がん化学療法
外来がん化学療法患者 年間約10,000件を実施・管理。
詳細については、外来化学療法センターの項をご参照くださいセカンドオピニオン
日本臨床腫瘍学会 指導医、がん薬物療法専門医による様々なセカンドオピニオンに随時対応しております。 40件/年程度
臨床試験・治験
数多くの臨床試験・治験を実施、各種臨床試験をはじめとし、国際共同臨床試験・開発治験(第Ⅱ相、第Ⅲ相)も多数実施しています。胃癌、大腸癌、膵臓癌、胆道癌、肝細胞癌など多くの癌腫で施行しております。
詳細は臨床試験・治験管理センターの項をご参照ください診療科別統計
主な疾患・治療法






臨床研究
治療介入を伴う臨床研究には、治験(企業主導と医師主導)と臨床試験(医師主導:多施設共同試験など)があります。未承認薬の安全性などを確認する早期臨床試験(第Ⅰ相試験)から、有効性や安全性を評価する第Ⅱ相試験、標準治療の確立や薬剤の承認申請を目的とした第Ⅲ相試験まで、幅広い研究実施体制を整えております。
臨床研究推進センター治験(企業主導と医師主導)
下表に現在実施中の治験の一部を紹介します。
| 試験名/課題名 | 対象疾患 | 試験薬 | 説明文 (PDF) |
| HER2陽性転移性結腸直腸癌の一次治療におけるトラスツヅマブ及びmFOLFOX6併用tucatinibの標準治療の比較試験 |
転移性結腸・直腸がん |
Tucatinib | |
|---|---|---|---|
| HER2陽性の切除不能な局所進行性または転移性胃食道腺癌(GEA)患者を対象としたチスレリズマブ併用又は非併用下で化学療法と組み合わせたzanidatamab(ザニダタマブ)の無作為化、多施設共同、第III相試験 |
HER2陽性の切除不能な局所進行性または転移性胃食道腺癌(GEA |
・Zanidatamab(ZW25) ・チスレリズマブ(BGB-A317) |
|
| ONO-4578-08:HER2 陰性で化学療法未治療の治癒切除不能な進行又は再発胃がん(食道胃接合部がんを含む)を有する被験者を対象とした ONO-4578、ニボルマブ、並びにフッ化ピリミジン系薬剤及びプラチナ系薬剤の化学療法(以下、化学療法)の併用療法の有効性及び安全性を、プラセボ、ニボルマブ及び化学療法の併用療法と比較する多施設共同第Ⅱ相無作為化二重盲検比較試験 |
治癒切除不能な進行・再発の胃癌 |
ONO-4578 | |
| 未治療の dMMR/MSI-H を有する T4N0 又は Stage III の切除可能な結腸癌患者を対象とした周術期治療としてのdostarlimab の第 III 相試験 |
結腸癌 |
dostarlimab | |
| ONO-7913 第I相試験 根治切除不能な進行又は再発の結腸・直腸がん患者を対象に、一次治療としてONO-7913、ONO-4538並びに標準治療であるFOLFOX及びベバシズマブ又はセツキシマブを併用する非盲検非対照試験 |
根治切除不能な進行又は再発の結腸・直腸がん |
ONO-7913・ONO-4538(Nivolumab) | |
| FGFR2bを過剰発現している未治療の進行性胃癌及び食道胃接合部癌患者を対象としたBemarituzumab+化学療法及びニボルマブとの併用療法と、化学療法及びニボルマブ併用療法とを比較する第Ib/III相試験 |
胃癌 |
Bemarituzumab | |
| 未治療のFGFR2b過剰発現進行性胃癌又は食道胃接合部癌患者を対象としたBemarituzumabと化学療法の併用投与とプラセボと化学療法の併用投与を比較する試験 |
胃癌 |
Bemarituzumab | |
| トラスツズマブ デルクステカンのHER2陽性の胃癌または胃食道接合部腺癌患者への二次治療を対象とした第3相臨床試験 | 胃癌 | DS-8201a |
臨床試験(医師主導:多施設共同試験など)
| 試験名/課題名 | 責任医師 | 承認日 | 説明文 (PDF) |
| がん診療に関する院内リアルワールドデータ(RWD)の網羅的収集および利活用に関する多施設共同研究(CONNECT-2) | 安井久晃 | 2024年2月 | |
|---|---|---|---|
| 実臨床におけるBRAF変異陽性切除不能大腸がんに対する観察研究 | 安井久晃 | 2024年2月 | |
| 京都大学医学部附属病院にてエキスパートパネルを受けた症例を対象とした多施設共同後ろ向き観察研究 | 安井久晃 | 2023年12月 | |
| 進行固形悪性腫瘍患者に対するAIマルチオミックスを活用したバイオマーカー開発の多施設共同研究(SCRUM-Japan MONSTAR-SCREEN-2) | 安井久晃 | 2021年6月 | |
| 悪液質合併消化器がんに対するアナモレリンの有用性を探索する後方視的観察研究 | 安井久晃 | 2023年5月 | |
| 血液循環腫瘍DNA陰性の高リスクStage II及び低リスクStage III結腸癌治癒切除例に対する術後補助化学療法としてのCAPOX療法と手術単独を比較するランダム化第III相比較試験(VEGA trial) | 安井久晃 | 2020年5月 | |
| 根治的外科治療可能の結腸・直腸癌を対象としたレジストリ研究 (GALAXY trial) | 安井久晃 | 2020年4月 | |
| 固形がん患者及び血縁者における生殖細胞系列遺伝子変異同定の有用性を評価する観察研究 | 安井久晃 | 2022年10月 | |
| 未治療進行又は再発胃がんを対象としたニボルマブ+ 化学療法の実臨床下における有効性と安全性に関する観察研究 | 安井久晃 | 2022年10月 | |
| 治癒切除不能な固形悪性腫瘍における血液循環腫瘍DNAのがん関連遺伝子異常及び腸内細菌叢のプロファイリング・モニタリングの多施設共同研究(SCRUM-Japan MONSTAR-SCREEN) | 安井久晃 | 2019年10月 | |
| 結腸・直腸癌を含む消化器・腹部悪性腫瘍患者を対象としたリキッドバイオプシーに関する研究; GI-screen付随研究GOZILAstudy | 安井久晃 | 2024年3月 |
その他、数多くの多施設共同の医師主導臨床試験を行っています。
それぞれの臨床研究には、対象となる患者さんの条件(適格基準、除外基準)があります。また、患者さんの募集状況は随時変わります。お問い合わせなどございましたら、下記までご連絡いただきますようお願いいたします。
連絡先
神戸市立医療センター中央市民病院 腫瘍内科部長 安井 久晃
神戸市中央区港島南町2丁目1-1
TEL 078-302-4321(大代表)
お知らせ
令和元年6月1日付けで、一部のがん患者さんに対するがん遺伝子パネル検査(OncoGuide NCCオンコパネル、FoundationOne CDx)(以下、本検査)が保険適用になりました。その運用には課題が多く、当院において長らくお待たせしておりましたが、この度、保険診療下での本検査を実施できるようになりました。詳しくは、『がんゲノム検査外来について』の項をご参照ください。
なお、自由診療によるがん遺伝子パネル検査も、従来通り実施しております。
腫瘍内科
先端医療センター病院 総合腫瘍科ならびに神戸市立医療センター中央市民病院 腫瘍内科を受診され、下記臨床研究への参加にご同意いただきました患者さんへ
当科で実施中の12研究は、医師の移動に伴い研究責任者が変更となりました。一部、臨床研究法施行により、研究実施体制も変更となっております。
当該研究の詳細につきましては、情報公開先にてご確認いただけます。
臨床研究実施計画・研究概要公開システム(jRCT) UMIN臨床試験登録システム【対象の臨床研究】
当院での被験者募集は、すべて終了いたしました
| 試験名 | 情報公開先 |
|---|---|
| 高齢者進展型小細胞肺がんに対するカルボプラチン+エトポシド併用療法(CE療法)とカルボプラチン+イリノテカン併用療法(CI療法)のランダム化比較第Ⅱ/Ⅲ相試験 (JCOG1201) | jRCTs031180193 |
| 高悪性度神経内分泌肺癌完全切除例に対するイリノテカン+シスプラチン療法とエトポシド+シスプラチン療法のランダム化比較試験(JCOG1206) | jRCTs031180216 |
| EGFR遺伝子変異陽性進行非扁平上皮非小細胞肺癌に対するゲフィチニブ単剤療法とゲフィチニブにシスプラチン+ペメトレキセドを途中挿入する治療とのランダム化比較試験(JCOG1404) | UMIN000020242 |
| 既治療の進行・再発非小細胞肺癌に対するドセタキセルとnab-パクリタキセルのランダム化比較第III相試験(J-AXEL) | jRCTs071180037 |
| 未治療原発不明癌に対する次世代シークエンスを用いた原発巣推定に基づく治療効果の意義を問う第II相試験(原発不明癌NGSCUP) | UMIN000016794 |
| EGFR 遺伝子変異を有する非小細胞肺癌患者に対する一次療法としてのベバシズマブ + エルロチニブ併用療法と エルロチニブ単剤療法を比較する非盲検無作為化比較第 III 相臨床試験(NEJ026) | jRCTs031180056 |
| EGFR遺伝子変異陽性75歳以上未治療進行非扁平上皮非小細胞肺癌に対するアファチニブの第Ⅱ相臨床試験(NEJ027) | jRCTs031180136 |
| 骨転移を有する肺癌を対象としたゾレドロン酸の4週間間隔投与と8週間間隔投与の有効性に関する無作為化第2相試験(阪神がん研究グループ0312試験) | jRCTs061180054 |
| 治療進行期非小細胞肺がんに対する緩和的放射線治療併用Nivolumab治療による照射野外病変に対するimmune priming効果の有効性および安全性を検討する第Ⅱ相試験(阪神がん0116/PRINCIPAL試験) | jRCTs051180174 |
| オシメルチニブ無効後の進行EGFR遺伝子変異陽性非小細胞肺癌患者に対するアファチニブ+ベバシズマブ併用療法の多施設共同単群第II相試験 | jRCTs051180205 |
| 特発性間質性肺炎を合併した進行扁平上皮肺癌に対するカルボプラチン+パクリタキセルの第Ⅱ相試験(IP合併001(Sq)) | jRCTs051180149 |
| 特発性間質性肺炎を合併した扁平上皮癌を除く進行非小細胞肺癌に対するカルボプラチン+パクリタキセル+ベバシズマブの第Ⅱ相試験(IP合併002(non-Sq)) | jRCTs061180046 |
問い合わせ先
該当の臨床研究に際し、ご質問がある方は、以下の「問い合わせ先」へご連絡ください。
【問い合わせ先】
神戸市立医療センター中央市民病院 腫瘍内科 部長
安井 久晃 ( やすい ひさてる )
〒650-0047 神戸市中央区港島南町2丁目1-1
電話番号:078-302-4321(代表)
| 月 | 火 | 水 | 木 | 金 | |
| 7:30〜 8:15 |
肺がん カンファレンス |
||||
|---|---|---|---|---|---|
| 8:15〜 8:30 |
腫瘍内科 カンファレンス |
乳がん カンファレンス |
婦人科腫瘍 カンファレンス |
||
| 8:30〜 8:50 |
|||||
| 8:50〜 9:30 |
外来化学療法 カンファレンス |
外来化学療法 カンファレンス |
外来化学療法 カンファレンス |
外来化学療法 カンファレンス |
外来化学療法 カンファレンス |
| 16:00〜 17:00 |
腫瘍内科回診 | ||||
| 17:30〜 18:00 |
第1:化学療法委員会 | ||||
| 18:00〜 19:00 |
消化器疾患 合同カンファレンス |
第1:キャンサーボード |
腫瘍内科は当院がんセンターのコア診療科の一つであり、がん患者さんの窓口となります。化学療法が必要な患者さんばかりでなく、確定診断に難渋している、もしくは最良の治療法がまだ決まらないといった場合にも、腫瘍内科でトリアージを行い、関連診療科と共同での診療に対応いたします。
がん化学療法に関しましては、消化器がんをはじめとする成人の固形がんの患者さんの対応を行います。さらに患者さんの希望に応じ、当院および紹介元/地域医療機関との医療連携による化学療法も可能です。
さらに新規抗がん剤の治験や臨床試験への参加にも対応可能ですので、ご興味のある患者さんがいらっしゃいましたらお声掛けいただけましたら幸いです。
2017年11月1日より先端医療センター病院は中央市民病院と統合され、南館として運用されます。それに伴い、先端医療センター病院の総合腫瘍科は中央市民病院腫瘍内科の1グループとして診療を継続することになります。 本館だけでなく南館にも腫瘍内科のベッドが割り当てられており、患者さんの状態や治療の目的に応じて入院病棟が決まります。
入院患者さんにおかれましては、入院中に病棟が替わる(本館内だけでなく本館⇔南館も)可能性がありますことをご了解くださいますようお願いいたします。